Расстройства питания — патологические состояния, развивающиеся в результате недостаточного или избыточного поступления и/или усвоения питательных веществ. Расстройства питания характеризуются нарушением физического развития, метаболизма, иммунитета, морфофункционального состояния внутренних органов и систем организма.
Согласно МКБ-10 в группу расстройств питания включены следующие рубрики.
• Е40-46 — белково-энергетическая недостаточность.
• Е50-64 — другие недостаточности питании (недостаточность витаминов и микроэлементов).
• Е65-68 — ожирение и другие виды избыточности питания.
БЕЛКОВО-ЭНЕРГЕТИЧЕСКАЯ НЕДОСТАТОЧНОСТЬ
Синонимы:
• дистрофия типа гипотрофии:
• гипотрофия:
• синдром недостаточности питания:
• синдром нарушенного питания;
• гипостатура;
• мальнутриция.
Синдром недостаточности питания — универсальное понятие, отражающее процессы, происходящие в организме при дефиците любого из незаменимых питательных веществ (белков и других источников энергии, витаминов, макро- и микроэлементов). Недостаточность питания может быть первичной, обусловленной неадекватным потреблением питательных веществ, и вторичной, связанной с нарушением приёма, ассимиляции или метаболизма нутриентов вследствие заболевания или травмы. Более узкое понятие «белково-энергетическая недостаточность» отражает изменения в организме, связанные с дефицитом преимущественно белка и/или иного энергетического субстрата.
Белково-энергетическая недостаточность (БЭН) — алиментарнозависимое состояние, вызванное преимущественным белковым и/или энергетическим голоданием достаточной длительности и/или интенсивности. БЭН проявляется комплексным нарушением гомеостаза в виде изменения основных метаболических процессов, водно-электролитного дисбаланса, изменения состава тела, нарушения нервной регуляции, эндокринного дисбаланса, угнетения иммунной системы, дисфункции ЖКТ и других органов и их систем.
Воздействие БЭН на активно растущий и развивающийся детский организм особенно неблагоприятно. БЭН вызывает существенную задержку физического и нервно-психического развития ребёнка, вследствие чего возникают нарушения иммунологической реактивности и толерантности к пище.
КОДЫ ПО МКБ-10
В МКБ-10 БЭН включена в класс IV «Болезни эндокринной системы, расстройства питания и нарушения обмена веществ».
Е40-Е46. Недостаточность питания.
Е40. Квашиоркор.
Е41. Алиментарный маразм.
Е42. Маразматический квашиоркор.
Е43. Тяжёлая белково-энергетическая недостаточность неуточнённая.
Е44. Белково-энергетическая недостаточность неуточнённая умеренной и слабой степени.
Е45. Задержка развития, обусловленная белково-энергетической недостаточностью.
Е46. Белково-энергетическая недостаточность неуточнённая.
ЭПИДЕМИОЛОГИЯ
Точных сведений о распространённости БЭН в настоящее время нет, поскольку пациенты с лёгким и среднетяжёлым течением этого заболевания в большинстве случаев не регистрируются. В России тяжёлую степень БЭН диагностируют примерно у 1-2% детей, в слаборазвитых странах этот показатель достигает 10-20%.
ПРОФИЛАКТИКА
В профилактике БЭН у детей раннего возраста большое значение имеют борьба за естественное вскармливание, организация правильного режима и ухода за ребёнком, предупреждение и своевременное лечение заболеваний, осложняющихся развитием БЭН. В старшем возрасте большое значение придают своевременной диагностике и адекватному лечению заболеваний, приводящих к развитию БЭН. В лечебно-профилактических учреждениях страны необходимо внедрение современных схем нутритивной поддержки больных, перенёсших хирургические операции, пациентов с острыми и хроническими заболеваниями, а также с травмами.
БЭН — социальная болезнь. К мерам её профилактики относят повышение уровня жизни населения и борьбу с бедностью, а также обеспечение доступности квалифицированной медицинской помощи широким слоям населения.
СКРИНИНГ
Скрининг БЭН заключается в постоянном мониторинге показателей физического развития (роста, массы тела) у детей раннего возраста и в последующие декретированные периоды. У больных детей, находящихся в стационарах и других лечебных учреждениях, необходимо контролировать показатели белкового обмена:
• уровень общего белка и белковых фракций;
• уровень мочевины в сыворотке крови;
• абсолютное количество лимфоцитов периферической крови.
КЛАССИФИКАЦИЯ
До настоящего времени в нашей стране не разработано общепризнанной классификации БЭН у детей, утверждённой на съездах педиатров. В мировой литературе и педиатрической практике наибольшее распространение получила классификация, предложенная Дж. Ватерлоу. В её последней модификации (табл. 7-1) выделяют 2 основные формы БЭН:
• острую, проявляющуюся преимущественно потерей массы тела и дефицитом массы тела по отношению к долженствующей массе тела по росту;
• хроническую, проявляющуюся не только дефицитом массы тела, но и существенной задержкой физического развития.
Обе формы имеют 3 степени тяжести: лёгкую, среднетяжёлую и тяжёлую.
Таблица 7-1. Классификация белково-энергетической недостаточности у детей (Дж. Ватерлоу, 1992)
|
Степень (форма) |
Острая БЭН |
Хроническая БЭН |
|
отношение массы тела к долженствующей массе тела по росту, % |
отношение роста к долженствующему росту по возрасту, % |
|
|
0 |
>90 |
>95 |
|
1 (лёгкая) |
81-90 |
90-95 |
|
II (среднетяжёлая) |
70-80 |
85-89 |
|
III (тяжёлая) |
<70 |
<85 |
В зависимости от причин, преимущественного характера голодания и механизмов его развития выделяют 3 основных клинико-патогенетических варианта БЭН:
• алиментарный маразм;
• квашиоркор;
• маразм-квашиоркор.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Острая белково-энергетическая недостаточность. Алиментарный маразм II степени.
ЭТИОЛОГИЯ
К развитию БЭН могут привести различные экзогенные и эндогенные этиологические факторы, вызывающие либо недостаточное поступление пищи в организм, либо её недостаточное усвоение. Среди экзогенных факторов до сих пор всё ещё велико значение алиментарных как в раннем, так и старшем возрасте. У детей первого года жизни это может быть связано с большой распространённостью гипогалактии у матерей и пищевой аллергии у детей, приводящих к количественному недокорму. Не менее важную роль в возникновении БЭН играют и качественные нарушения питания: дефицит витаминов, недостаток или избыток какого-либо пищевого вещества (белка, жира или углеводов). При повышенной белковой нагрузке утилизация белка снижается, в организме накапливаются азотистые продукты (аминокислоты, аммиак), возникает ацидоз, что ведёт к появлению дистрофических изменений в мозговой ткани и паренхиматозных органах. Особенно неблагоприятен избыток белка на фоне недостатка углеводов. Несбалансированное питание с избыточным поступлением легкоусваяемых углеводов и дефицитом белка также негативно сказывается на развитии ребёнка. Квашиоркор — особая форма БЭН, развивающаяся в условиях выраженного белкового голодания при умеренном поступлении углеводов и жиров и наслоении инфекционного процесса.
В качестве причин развития наиболее тяжёлых форм БЭН в настоящее время чаще выступают эндогенные факторы (табл. 7-2), требующие своевременной и адекватной коррекции нутритивного статуса. К развитию БЭН часто приводят острые и хронические инфекционные заболевания.
Таблица 7-2. Причины развития недостаточности питания
|
Причины развития |
Клинические состояния |
|
Нарушения приёма пищи |
Утрата сознания Нарушение акта глотания Неукротимая рвота Обструкция пищеварительного канала Нервная анорексия |
|
Нарушения пищеварения (мальди- гестия) |
Ферментная недостаточность Панкреатит Гастрэктомия Резекция тонкой кишки Билиарная недостаточность |
|
Нарушения всасывания (мальаб- сорбция) |
Дефекты ферментных и транспортных систем кишки Энтерит Болезнь Крона Синдром короткой кишки Фистула кишечника |
|
Нарушения обмена веществ |
Врождённые нарушения метаболизма Эндокринные нарушения Взаимодействие нутриентов и медикаментов Катаболические состояния (такие как ожоги, сепсис и тяжёлые инфекционные заболевания, травма, хирургические операции) |
ПАТОГЕНЕЗ
Несмотря на многообразие этиологических факторов, вызывающих развитие БЭН у детей, в основе её патогенеза лежит хроническая стрессовая реакция — одна из универсальных неспецифических патофизиологических реакций организма, возникающих при многих заболеваниях, а также при длительном действии разнообразных повреждающих факторов. Все нервные, эндокринные и иммунные механизмы регуляции организма человека современные исследователи объединяют в единую систему, обеспечивающую постоянство гомеостаза.
Воздействие стрессовых факторов вызывает сложные изменения и комплексную реакцию всех звеньев нейроэндокринно-иммунной системы (рис. 7-1), при-
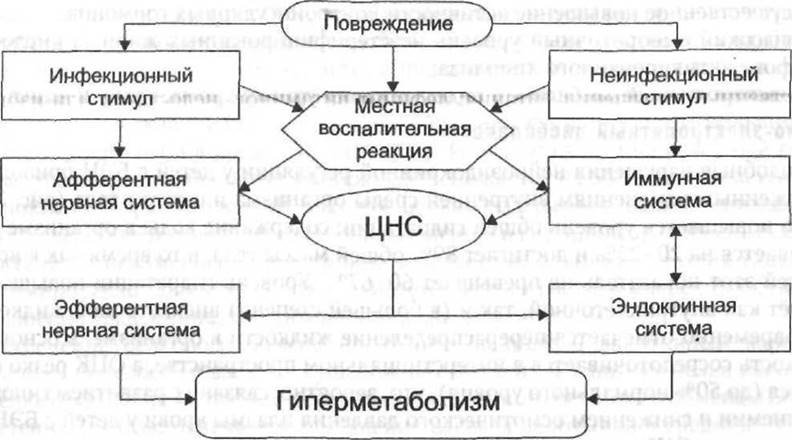
Рис. 7-1. Развитие постагрессивной реакции (Попова Т.С., 2002, с модификацией).
водящую к кардинальной перестройке метаболических процессов и изменению реактивности организма. У ребёнка резко возрастает интенсивность основного обмена и потребности в энергии и пластическом материале существенно повышаются (табл. 7-3).
Таблица 7-3. Повышенные потребности в белке и калориях при патологии у детей (Koletzko В., 2004)
|
Состояние |
Клинические проявления |
Потребность |
|
|
энергия, % |
белок, % |
||
|
Здоров |
Отсутствуют |
100 |
100 |
|
Лёгкий стресс |
Анемия, лихорадка, лёгкая инфекция, малые хирургические вмешательства |
100-120 |
150-180 |
|
Умеренный стресс |
Костно-мышечная травма, обострение хронического заболевания |
120-140 |
200-250 |
|
Значимый стресс |
Сепсис, тяжёлая травма, большие хирургические вмешательства |
140-170 |
250-300 |
|
Выраженный стресс |
Тяжёлые ожоги, быстрая реабилитация при БЭН |
170-200 |
300-400 |
Гормональный ответ при БЭН носит комбинированный характер, однако преобладает катаболическая направленность процессов. Повышение уровня катехоламинов, глюкагона и кортизола (мощных катаболических гормонов) приводит к усилению липолиза и деструкции белка с мобилизацией аминокислот (в первую очередь, из скелетной мускулатуры), а также к активации печёночного глюконео-генеза. Кроме того, увеличивается активность тиреоидных гормонов, отмечается повышение уровня антидиуретического гормона и развитие гиперальдостеронизма, что существенно изменяет электролитный баланс в организме ребёнка с БЭН. Помимо катаболических, усиливается продукция и анаболических гормонов, в частности СТГ, однако его концентрация повышается на фоне низкого уровня соматомединов и инсулиноподобного фактора роста, что полностью нивелирует его активность. Уровень другого анаболического гормона — инсулина — при БЭН обычно снижен, кроме того, его активность нарушается на рецепторном и пострецепторном уровне. Возможные причины инсулинорезистентности при БЭН:
• существенное повышение активности контроинсулярных гормонов;
• высокий сывороточный уровень неэстерифицированных жирных кислот на фоне активированного липолиза;
• электролитный дисбаланс в виде снижения уровня хрома, калия и цинка.
Водно-электролитный дисбаланс
Подобные нарушения нейроэндокринной регуляции у детей с БЭН приводят к выраженным изменениям внутренней среды организма и состава тела (рис. 7-2). Резко повышается уровень общей гидратации: содержание воды в организме увеличивается на 20-25% и достигает 89% общей массы тела, в то время как в норме у детей этот показатель не превышает 60-67%. Уровень гидратации повышается за счёт как внутриклеточной, так и (в большей степени) внеклеточной жидкости. Одновременно отмечается перераспределение жидкости в организме: в основном жидкость сосредоточивается в интерстициальном пространстве, а ОЦК резко снижается (до 50% нормального уровня), что, вероятно, связано с развитием гипоальбуминемии и снижением осмотического давления плазмы крови у детей с БЭН.
Снижение ОЦК вызывает уменьшение почечного плазмотока и фильтрации, что стимулирует дальнейшее повышение продукции антидиуретического гормона
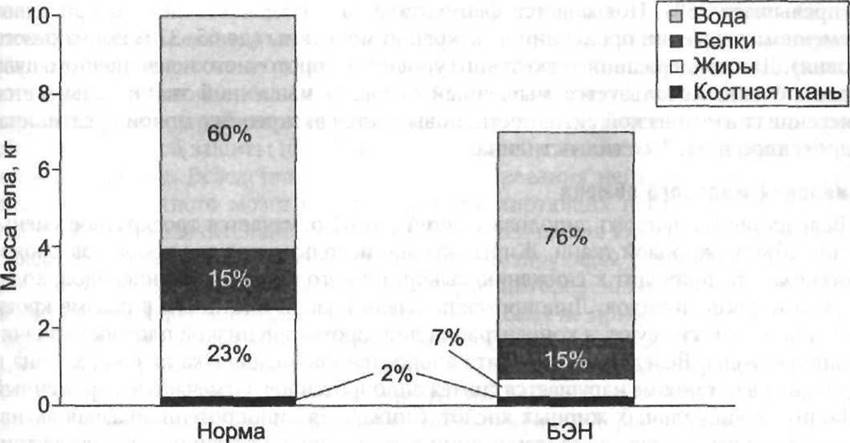
Рис. 7-2. Изменение состава тела у детей при белково-энергетической недостаточности (Goulet О., 1998, с модификацией).
и альдостерона и задержку натрия и воды в организме, замыкая порочный круг. У детей с БЭН отмечается резкий избыток натрия в организме даже при отсутствии отёков, причём натрий аккумулируется преимущественно в межклеточном пространстве. Содержание общего натрия организма при БЭН повышается почти в 8 раз, в то время как его сывороточный уровень может оставаться в пределах нормы или быть слегка повышенным. Уровень общего калия в организме снижается до 25-30 ммоль/кг, у здорового ребёнка этот показатель составляет 45-50 ммоль/кг. Снижение содержания общего калия непосредственно связано с угнетением белкового синтеза и ретенцией натрия в организме. При БЭН снижается уровень и других минералов: магния (на 20-30%), фосфора, железа, цинка, меди. Отмечается дефицит большинства водо- и жирорастворимых витаминов.
Изменения белкового обмена
Наибольшим изменениям при БЭН подвержен белковый обмен. Содержание общего белка в организме ребёнка с БЭН снижается на 20-30%. Отмечается снижение как мышечного (на 50%), так и висцерального пула белка. Общий уровень альбумина в организме снижается на 50%, однако внесосудистый пул альбумина активно мобилизуется и возвращается в циркуляцию. В плазме крови падает концентрация большинства транспортных белков: трансферрина, церулоплазмина, ретинол-связывающего белка. Снижается уровень фибриногена и большинства факторов свёртывания крови (II, VII, X, V). Изменяется аминокислотный состав белка: уровень эссенциальных аминокислот снижается на 50%, уменьшается доля аминокислот с разветвлённой боковой цепью, содержание валина снижается в 8 раз. Вследствие подавления катаболизма лизина и гистидина их уровень остаётся практически неизменным. Содержание в организме аланина и других гликоген- ных аминокислот значительно увеличивается за счёт распада мышечных белков и повышения трансаминазной активности в мышечной ткани.
Изменение белкового обмена носит постепенный и адаптивный характер. Организм приспосабливается к существенно сниженному потоку белка извне, и у ребёнка с БЭН отмечается «консервация» собственного белкового обмена. Помимо угнетения синтеза, отмечается замедление распада альбумина в среднем на 50%. Период полужизни альбумина удваивается. При БЭН эффективность реутилизации аминокислот в организме возрастает до 90-95%, в норме этот показатель не превышает 75%. Повышается ферментативная активность печени при одновременном угнетении продукции и экскреции мочевины (до 65-37% нормального уровня). Для поддержания адекватного уровня сывороточного и печёночного пула белка активно используется мышечный белок. В мышечной ткани развивается угнетение синтетической активности, повышается экскреция с мочой креатинина, гидроксипролина, 3-метилгистидина.
Изменения жирового обмена
Вследствие усиленного липолиза у детей с БЭН отмечается троекратное уменьшение объёма жировой ткани. Жиры активно используются для процессов глюконеогенеза, что приводит к снижению сывороточного уровня триглицеридов, холестерина и фосфолипидов. Липопротеиды очень низкой плотности в плазме крови практически отсутствуют, а концентрация липопротеидов низкой плотности значительно снижена. Вследствие дефицита апопротеинов, недостатка лизина, холина и карнитина в организме нарушается синтез липопротеидов. Отмечается выраженный дефицит эссенциальных жирных кислот. Сниженная липопротеинлипазная активность приводит к нарушению утилизации триглицеридов в тканях; перегрузка триглицеридами (их содержание повышается на 40%) при недостаточном количестве липопротеидов низкой плотности негативно сказывается на функции печени, что приводит к развитию баллонной и жировой дистрофии гепатоцитов.
Изменения желудочно-кишечного тракта
Дистрофические изменения в слизистой оболочке тонкой кишки приводят к атрофии ворсинок и исчезновению щеточной каёмки. Нарушается секреторная функция пищеварительных желёз, снижается кислотность желудочного сока, развивается угнетение продукции и активности пищеварительных ферментов и билиарных секретов. Страдает барьерная функция слизистой оболочки кишки: нарушается межклеточное взаимодействие энтероцитов, угнетается продукция лизоцима и секреторного иммуноглобулина А. Вследствие дистрофии мышечных слоёв кишечной стенки нарушается кишечная моторика, развивается общая гипотония и дилатация с периодическими волнами антиперистальтики. Подобные изменения ЖКТ приводят к развитию мальдигестии, мальабсорбции, восходящей бактериальной контаминации тонкой кишки и усугублению БЭН.
Изменения сердечно-сосудистой системы
Со стороны сердечно-сосудистой системы у детей с БЭН наблюдается склонность к развитию централизации кровообращения, возникающая на фоне гиповолемии її проявляющаяся гипердинамической реакцией миокарда, лёгочной гипертензией, спастическим состоянием прекапиллярных артериол, нарушением микрогемоциркуляции с признаками «сладж-синдрома» в микрососудах. Гемодинамические расстройства патогенетически связаны с хронической стрессовой реакцией. При БЭН I и И степени отмечают нарастающую симпатикотонию и усиливающуюся активность центрального контура регуляции, при III степени — «срыв адаптации», децентрализацию регуляции с переходом на автономные уровни. При тяжёлой форме БЭН отмечают отрицательный хронотропный эффект, склонность к гипотензии, брадикардии и высокий риск развития гиповолемического шока. Однако инфузионную терапию следует применять крайне осторожно, так как вследствие высокой гидратации тканей, изменения микроциркуляторного русла и развития натрий-калиевого дисбаланса велик риск быстрого развития сердечно-сосудистой недостаточности и синдрома внезапной смерти из-за асистолии.
Изменения иммунной системы
При БЭН у детей развивается транзиторный вторичный иммунодефицит (метаболическая иммунодепрессия по В.М. Дильману). В качестве патогенетического звена нарушений иммунологической реактивности при БЭН выступают метаболические сдвиги, связанные с выраженным дефицитом пластического материала (белка), неустойчивостью углеводного обмена с пиками транзиторной гипергликемии и переключением обмена веществ преимущественно на липидный. Отмечают нарушения как врождённого, так и приобретённого иммунитета. Нарушения врождённой иммунной защиты при БЭН в наибольшей степени касаются микроцитарного фагоцитоза. Вследствие нарушенного созревания нейтрофилов и их мобилизации из костного мозга количество циркулирующих нейтрофилов при БЭН уменьшается незначительно, однако их функциональная активность существенно страдает: угнетается хемитаксическая и опсонизирующая активность нейтрофилов, нарушается их способность к лизису фагоцитированных бактерий и грибов. Функция макрофагов страдает незначительно. БЭН не приводит к существенным нарушениям системы комплемента, однако при наслоении инфекции последняя быстро истощается. Отмечают снижение численности и литической активности NK-клеток. Со стороны приобретённого иммунитета при БЭН наибольшему повреждению подвергается клеточное звено иммунной защиты. Отмечается угнетение как первичного, так и вторичного клеточного иммунного ответа. Снижается абсолютное количество Т-клеток, особенно CD4, нарушается соотношение CD4/ CD8. Уровень иммуноглобулинов обычно не изменён, однако эти антитела обладают низкой аффинностью и специфичностью.
Квашиоркор — особый вариант БЭН, в его развитии существенную роль придают преимущественно углеводной диете с резким дефицитом белковой пищи и наслоению вторичной инфекции на фоне недостаточного питания и нарушенной адаптации (рис. 7-3), что вызывает существенную перестройку обменных процессов в организме и в первую очередь — белково-синтетической функции печени. В печени блокируется синтез висцеральных транспортных белков (таких как альбумин, трансферрин, липопротеиды) и активируется продукция белков острой фазы, необходимых для обеспечения воспалительного ответа организма. На фоне дефицита транспортных белков быстро развиваются гипоонкотические отёки и жировая дистрофия печени. Квашиоркор, как и другие формы БЭН, — проявление классической стрессовой реакции, но её развитие ускорено, поэтому описанные выше нарушения гомеостаза справедливы и для данной формы БЭН, однако они носят более острый и интенсивный характер.
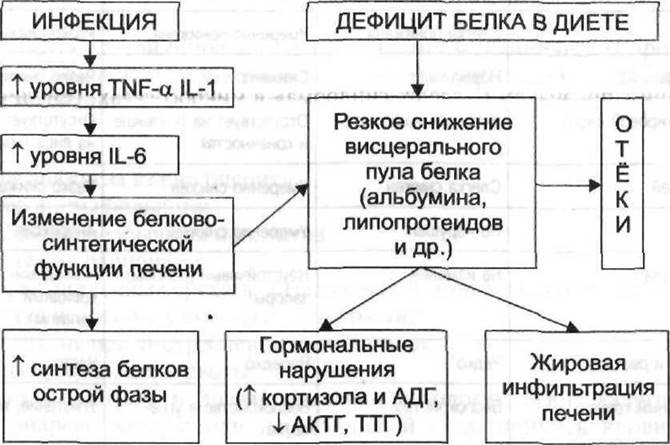
Рис. 7-3. Схема патогенеза квашиоркора.
КЛИНИЧЕСКАЯ КАРТИНА
Для клинической картины каждого из 3 основных клинико-патогенетических вариантов БЭН: маразма, квашиоркора и переходного варианта - маразма- квашиоркора — характерны не только свои особенности, но и общие черты. В клинической картине любой формы БЭН можно выделить следующие основные клинические синдромы:
• недостаточную упитанность;
• трофические расстройства;
• пониженную пищевую толерантность;
• изменения функционального состояния ЦНС;
• нарушения иммунологической реактивности.
Маразм — результат тяжёлого белкового и энергетического голодания, часто сопровождающегося дефицитом основных витаминов и минералов. Вследствие активной утилизации мышечных белков для поддержания адекватной концентрации висцеральных белков заболевание клинически проявляется резким истощением. Кожа у таких больных приобретает серый оттенок, становится цианотич- ной, сухой, полностью утрачивает эластичность, легко возникают изъязвления и пролежни. Отмечают полное отсутствие подкожного жирового слоя. Вследствие отсутствия жировых комочков Биша лицо приобретает треугольную форму, становится морщинистым, заметны впалые щёки. Подобные изменения клиницисты прошлого описывали ёмким определением — «лицо Вольтера». У таких пациентов отмечают явление хейлита и мукозитов, сквозь истончённую кожу живота кон- турируются петли кишечника, наполненные газами. Выраженность отмеченных клинических проявлений зависит от степени тяжести БЭН (табл. 7-4).
Таблица 7-4. Основные клинические проявления алиментарного маразма у детей раннего возраста
|
Клинические признаки |
Степень гипотрофии |
||
|
I |
II |
III |
|
|
Дефицит массы тела |
11-20% |
21-30% |
Более 30% |
|
Соотношение массы и длины тела |
Р -Р Р25 - Р10 |
Р10-РЗ |
Меньше РЗ |
Состояние кожных покровов:
|
цвет |
Бледный |
Бледно-серый |
Серовато-цианотичный |
|
влажность |
Слегка понижена |
Умеренно понижена |
Резко снижена |
|
эластичность |
Нормальная |
Снижена |
Резко снижена |
|
Подкожно-жировой слой |
Истончён на животе |
Отсутствует на туловище и конечностях |
Отсутствует везде, даже на лице («лицо Вольтера») |
|
Тургор тканей |
Слегка снижен |
Умеренно снижен |
Резко снижен |
|
Аппетит |
Не нарушен |
Умеренно снижен |
Анорексия |
|
Характер стула |
Не изменён |
Неустойчивый (поносы, запоры) |
«Голодный» (сухой, крошковидный, с гнилостным запахом) |
|
Срыгивания и рвота |
Редко |
Нередко |
Часто |
|
Эмоциональный тонус |
Беспокойство |
Беспокойство и угнетение |
Угнетение, апатия |
|
Мышечный тонус |
Лёгкая гипотония |
Умеренная гипотония |
Резкая гипотония |
Окончание табл. 7-4
|
Физиологические рефлексы |
Не нарушены |
Умеренная гипорефлексия |
Значительная гипорефлексия |
|
|
Психомоторное развитие |
Соответствует возрасту |
Отстаёт от нормы |
Исчезают приобретённые навыки |
|
|
Иммунобиологическая резистентность |
Нормальная или слегка снижена |
Значительно снижена. Транзиторный вторичный иммунодефицит |
||
Для типичной клинической картины квашиоркора характерна тетрада Джелифара, включающая:
• отёки;
• отставание в физическом развитии;
• атрофию мышц с сохранением подкожного жирового слоя;
• отставание в нервно-психическом развитии.
Обычно отёки сначала появляются на тыльной поверхности стоп, затем они распространяются на другие участки тела. Вследствие нарушения продукции меланотропного гормона отмечают гипопигментацию кожи, проявляющуюся также поэтапно. Сначала гипопигментация появляется в локтевых и паховых складках, затем на лице, далее поражается кожа туловища и ребёнок приобретает характерный вид — «красный ребёнок». Одновременно отмечают участки гиперпигментации с неровными контурами (локти, наружные поверхности бёдер), явления отслойки эпидермиса, истончения слизистых оболочек, ангулярный стоматит, перианальные трещины. Кроме того, у этих больных часто развивается депигминтация волос, гепато- (за счёт жировой инфильтрации и отёка) и спленомегалия. Характерны гипотермия (температура тела ниже 35,6 °С), апатия, заторможённость, «маска страдания», выраженная вялость, летаргическое оцепенение. Пациенты лежат в позе плода для уменьшения теплоотдачи. Состояние больных с квашиоркором прогрессивно ухудшается вследствие выраженной анорексии, замыкающей порочный круг.
Маразм-квашиоркор сочетает признаки маразма и квашиоркора в виде выраженной атрофии и отёков. Изменения кожи и волос умеренно выражены, характерна жировая инфильтрация печени. Заболевание развивается в результате тяжёлого белкового и энергетического голодания при наслоении инфекции.
ДИАГНОСТИКА
Диагноз «БЭН» у детей основан на данных анамнеза, клинических проявлениях заболевания, оценке антропометрических показателей и данных лабораторных методов исследования.
Анамнез
При сборе анамнеза важно оценить:
• характер диеты больного;
• употребление необычных продуктов;
• резкую смену рациона;
• приём лекарственных средств, витаминных и минеральных добавок;
• появление необычных вкусовых пристрастий;
• попёрхивание при употреблении густой пищи;
• эпизоды срыгивания и рвоты.
Необходимо отметить и другие признаки патологии ЖКТ: вздутие и боли в животе, диарею, запоры или неустойчивый стул, примесь крови в стуле. Необходимо выяснить, не отмечалась ли общая слабость, повышенная утомляемость, снижение умственной работоспособности, нарушение сумрачного зрения, боли в костях, мышечные боли, судороги и подёргивания, онемение, парестезии в конечностях. Для постановки диагноза БЭН важна оценка динамики антропометрических показателей, особенно изменения массы тела за последние 6 мес.
При физикальном обследовании детей с подозрением на БЭН необходимо оценить состояние кожи и её придатков:
• степень сухости кожи;
• наличие сыпи, петехий;
• изменения цвета и качества волос, их выпадение;
• состояние видимых слизистых оболочек (явления хейлита, глоссит, малиновый язык, кератомаляция);
• состояние зубов.
При осмотре больного отмечают истончение или исчезновение подкожного жирового слоя, потерю мышечной массы. Возможно развитие отёков, гепатоме- галии, периферической нейропатии. Эти и другие симптомы у детей не только отражают дефицит белка и энергии, но и служат признаками полинутриентной недостаточности (табл. 7-5).
Таблица 7-5. Симптомы дефицита макро- и микронутриентов
|
Симптомы |
Дефицит нутриентов |
|
|
Общие . |
Слабость, быстрая утомляемость, снижение массы тела, мышечная слабость |
Белок, калораж |
|
Кожа |
Бледность |
Фолацин, Fe, витамин В,2 |
|
Фолликулярный гиперкератоз, истончение, сухость и шероховатость |
Витамин А, витамин С, биотин |
|
|
Перифолликулярные петехии |
Витамин С |
|
|
Дерматит |
Белок, калораж, витамин РР, витамин Вг, Zn, витамин А, незаменимые жирные кислоты |
|
|
Спонтанные кровоизлияния, геморрагии, петехии |
Витамин С, витамин К, полифенолы |
|
|
Волосы |
Аллопеция |
Белок, Zn |
|
Тонкие, ломкие |
Биотин, пантотеновая кислота, витамин С, витамин А |
|
|
Глаза |
Гемеролопия, ксерофтальмия, кератомаляция, фотофобия, ощущение песка, ксероз конъюнктивы роговицы |
Витамин А |
|
Конъюнктивит |
Витамин А, витамин В2 |
|
|
Язык |
Глоссит |
Витамин В2, витамин РР, витамин В12 |
|
Кровоточивость дёсен, эрозии и язвочки слизистых оболочек |
Фолацин, белок, витамин А, витамин С, витамин К |
|
|
Покалывание и жжение, болезненность, увеличение и набухание сосочков |
Фолацин, витамин В12, витамин С, витамин РР |
|
|
Ангулярный стоматит, хейлоз |
Фолацин, Fe, витамин В2, витамин РР, витамин В12 |
|
|
Нервная |
Тетания |
Са, Мg |
|
система |
Парестезии |
Витамин В1, витамин В6 |
|
Снижение рефлексов, мышечная дистрофия, атаксия, гилеркинезы |
Витамин В12, витамин В2, витамин Е |
|
|
Деменция, дезориентация |
Ниацин, витамин В12 |
|
|
Офтальмоплегия |
Витамин Е, витамин В1 |
|
|
Депрессия |
Биотин, фолацин, витамин В12 |
До настоящего времени критерии оценки состояния питания здорового и больного человека недостаточно проработаны и научно обоснованы. Необходимы большие популяционные исследования антропометрических показателей населения страны с учётом пола, возраста, состояния здоровья пациента и социальных факторов. Существующие классификации состояния питания человека, как правило, основаны на оценке величины отклонения фактической массы тела от её идеального (должного, нормального, расчётного) значения. Однако величина массы тела зависит от многих факторов: возраста, конституции, пола, предшествующего питания, условий жизни, характера труда, образа жизни и т.д. Согласно рекомендациям экспертов по питанию ФАО/ВОЗ, наиболее простой, общепринятый и высокоинформативный критерий для оценки состояния питания — так называемый индекс массы тела (ИМТ), или индекс Кетле, рассчитываемый как отношение массы тела (в килограммах) к росту (в метрах), возведённому в квадрат. На основе данного показателя построены многие классификации нарушенного питания (табл. 7-6).
Таблица 7-6. Оценка статуса питания у детей старше 12 лет по индексу массы тела (Гурова М.М., Хмелевская И.Г., 2003)
|
Вид нарушения питания |
Степень |
Индекс массы тела |
|
Ожирение |
III |
>40 |
|
II |
30-40 |
|
|
1 |
27,5-29,9 |
|
|
Повышенное питание |
23,0-27,4 |
|
|
Норма |
19,5≤Х<22,9 |
|
|
Пониженное питание |
18,5-19,4 |
|
|
Белково-энергетическая недостаточность |
1 |
17-18,4 |
|
II |
15-16,9 |
|
|
III |
<15 |
|
При оценке состояния питания у детей большинство критериев и классификаций нарушенного питания использовать трудно или даже невозможно. Необходимо учитывать возраст и быстрые темпы роста детского организма. Расчёт ИМТ для детей младшего возраста малоинформативен, и его можно использовать только у детей старше 12 лет; у детей младше 12 лет в качестве критерия БЭН используют процент отклонения от долженствующей массы. Для определения степени тяжести БЭН у детей младшего возраста в мире широко применяют классификацию Дж. Ватерлоу (см. табл. 7-1).
Долженствующую (идеальную) массу тела у детей определяют с использованием таблиц центильных или перцентельных распределений массы тела в зависимости от роста и возраста ребёнка.
Помимо длины и массы тела при исследовании антропометрических показателей у детей оценивают окружность головы, груди, живота, плеча, бедра, а также толщину кожно-жировых складок в стандартных точках. У детей раннего возраста большое значение придают показателям окружности головы, количеству зубов и размерам родничков.
Результаты лабораторных исследований у детей с БЭН обнаруживают существенные изменения со стороны биохимических маркёров белкового обмена: при маразме характерно умеренное снижение содержания общего белка и альбумина сыворотки крови, снижение абсолютного количества лимфоцитов периферической крови; при квашиоркоре уровень альбумина и других транспортных белков снижены значительно. Уровень мочевины у детей с БЭН резко снижен или находится на нижней границе нормы, при этом уровень креатинина практически не меняется. В моче может повышаться уровень креатинина, общий азот мочи обычно снижен.
Белки сыворотки крови — более показательные маркёры белкового голодания, чем объём мышечной массы, однако их чувствительность к изменению внутренней среды зависит от их периода полуобмена (табл. 7-7). Для мониторинга эффективности проводимого лечения лучше использовать короткоживущие белки.
Таблица 7-7. Белковые маркёры питательного статуса (Cynober L, 2000)
|
Белок |
Период полужизни, дни |
Концентрация в крови |
|
Альбумин |
20 |
42±2 г/л |
|
Трансферрин |
8 |
2,8±0,3 г/л |
|
Транстиретин |
2 |
310±35 мг/л |
|
Ретинол-связывающий белок |
0,5 |
62±7 мг/л |
Помимо нарушения белкового обмена у детей с БЭН часто отмечают:
• полицитемию и повышенную вязкость крови;
• склонность к гипогликемии;
• гипокалиемию;
• гипокальциемию;
• гипомагниемию и склонность к гипернатриемии;
• существенные гормональные сдвиги.
Показатели иммунограммы указывают на вторичный иммунодефицит с угнетением клеточного иммунитета (уменьшение количества Т-лимфоцитов) и нарушенной фагоцитарной активностью нейтрофилов; уровень иммуноглобулинов класса М, G и А может сохраняться на нормальном уровне. Изменения копрограммы вариабельны и зависят от типа пищевого нарушения:
• при «молочном расстройстве питания»:
❖ щелочная реакция кала;
❖ повышенное содержание известковых и магниевых солей;
• при «мучном расстройстве питания»:
❖ кислая реакция кала;
❖ повышенное содержание внеклеточного крахмала, перевариваемой клетчатки, жирных кислот, слизи и лейкоцитов.
Инструментальное обследование выявляет быстрое истощение при выполнении функциональных проб. При проведении динамометрии и дыхательных проб отмечают существенное падение определённых показателей, указывающее на мышечную слабость. При проведении ЭКГ обнаруживают признаки метаболических изменений в миокарде желудочков; при кардиоинтервалографии — признаки симпатикотонии при I и II степени гипотрофии, признаки ваготонии — при III степени; при эхокардиографии (ЭхоКГ) — гипердинамическую реакцию миокарда при I и II степени гипотрофии, гиподинамическую — при III степени.
Дифференциальная диагностика
При осмотре ребёнка с гипотрофией в первую очередь определяют заболевание, вызвавшее у него гипотрофию. В связи с этим необходимо дифференцировать следующие заболевания:
• инфекционные;
• хронические заболевания ЖКТ;
• наследственные и врождённые энзимопатии;
• эндокринные заболевания;
• органические заболевания ЦНС и т.д.
Показания к консультации других специалистов
Детям с БЭН, особенно с её хронической формой, необходима консультация медицинского генетика и эндокринолога в целях исключения генетических синдромов, а также наследственных и эндокринных заболеваний, требующих специализированной терапии. При нарушениях акта жевания и глотания показана консультация невролога, а при нарушенном пищевом поведении, неврогенной анорексии показана консультация медицинского психолога и детского психиатра. В обследовании ребёнка с БЭН необходимо участие гастроэнтеролога в целях исключения первичной гастроэнтерологической патологии, а при необычном эпидемиологическом анамнезе и признаках инфекционного или паразитарного заболевания необходима консультация врача-инфекциониста.
При лечении детей с тяжёлыми формами БЭН, особенно при признаках полиорганной недостаточности, в целях коррекции проводимой инфузионной терапии и парентерального питания может потребоваться участие врачей отделения интенсивной терапии.
ЛЕЧЕНИЕ
Лечение детей с БЭН I степени обычно проводят в амбулаторных условиях, а детей с БЭН II и III степени — в стационаре. Лечение таких детей необходимо проводить комплексно, то есть включать сбалансированную нутритивную поддержку и диетотерапию, фармакотерапию, адекватный уход и реабилитацию больного ребёнка.
В 2003 г. экспертами ВОЗ разработаны и опубликованы рекомендации по ведению детей с БЭН, где регламентированы все мероприятия по выхаживанию детей с недостаточностью питания. Ими выделено 10 основных шагов:
• предупреждение/лечение гипогликемии;
• предупреждение/лечение гипотермии;
• предупреждение/лечение дегидратации;
• коррекция электролитного дисбаланса;
• предупреждение/лечение инфекции;
• коррекция дефицита микронутриентов;
• осторожное начало кормления;
• обеспечение прибавки массы тела и роста;
• обеспечение сенсорной стимуляции и эмоциональной поддержки;
• дальнейшая реабилитация.
Мероприятия проводят поэтапно (рис. 7-4) с учётом тяжести состояния больного ребёнка, начиная с коррекции и профилактики состояний, угрожающих жизни.

Рис. 7-4. Этапы выхаживания детей с белково-энергетической недостаточностью.
Первый шаг направлен на лечение и профилактику гипогликемии и связанных с ней возможных нарушений сознания у детей с БЭН. Если сознание не нарушено, но уровень глюкозы сыворотки крови ниже 3 ммоль/л, то ребёнку показано болюсное введение 50 мл 10% раствора глюкозы или сахарозы (1 ч.л. сахара на 3,5 ст.л. воды) через рот или назогастральный зонд. Затем таких детей кормят часто — каждые 30 мин в течение 2 ч в объёме 25% объёма обычного разового кормления с последующим переводом на кормление каждые 2 ч без ночного перерыва. Если ребёнок находится без сознания, в летаргии, или у него гипогликемические судороги, то ему необходимо внутривенно ввести 10% раствор глюкозы из расчёта 5 мл/кг. Затем проводят коррекцию гликемии введением растворов глюкозы (50 мл 10% раствора) или сахарозы через назогастральный зонд и переводом на частые кормления каждые 30 мин в течение 2 ч, а далее каждые 2 ч без ночного перерыва. Всем детям с нарушениями сывороточного уровня глюкозы показано проведение антибактериальной терапии препаратами широкого спектра действия.
Второй шаг заключается в профилактике и лечении гипотермии у детей с БЭН. Если ректальная температура ребёнка ниже 35,5 °С, то его необходимо срочно согреть: одеть в тёплую одежду и шапку, укутать тёплым одеялом, уложить в кроватку с подогревом или под источник лучистого тепла. Такого ребёнка необходимо срочно накормить, назначить антибиотик широкого спектра действия и проводить регулярный мониторинг уровня сывороточной гликемии.
Третий шаг — лечение и профилактика дегидратации. Дети с БЭН имеют выраженные нарушения водно-электролитного обмена, ОЦК у них может быть низким даже на фоне отёков. Вследствие опасности быстрой декомпенсации состояния и развития острой сердечной недостаточности у детей с БЭН для регидратации не следует использовать внутривенный путь, за исключением случаев гиповолемического шока и состояний, требующих интенсивной терапии. Стандартные солевые растворы, использующиеся для регидратационной терапии при кишечных инфекциях и, в первую очередь, при холере, для детей с БЭН не применяют из-за слишком высокого содержания в них ионов натрия (90 ммоль/л Na+) и недостаточного количества ионов калия. При недостаточности питания следует использовать специальный раствор для регидратации детей с БЭН — ReSoMal (Rehydratation Solution for Malnutrition), 1 литр которого содержит 45 ммоль ионов натрия, 40 ммоль ионов калия и 3 ммоль ионов магния.
Если у ребёнка с БЭН клинически выражены признаки дегидратации или водянистая диарея, то ему показано проведение регидратационной терапии через рот или назогастральный зонд раствором ReSoMal из расчёта 5 мл/кг каждые 30 мин
в течение 2 ч .В последующие 4-10 ч раствор вводят по 5-10 мл/кг в ч, заменяя введение регидратационного раствора на кормление смесью или материнским молоком в 4, 6, 8 и 10 ч. Таких детей также необходимо кормить каждые 2 ч без ночного перерыва. Им следует проводить постоянный мониторинг состояния. Каждые 30 мин в течение 2 ч, а далее каждый час в течение 12 ч следует оценивать частоту пульса и дыхания, частоту и объём мочеиспусканий, стула и рвоты.
Четвёртый шаг направлен на коррекцию электролитного дисбаланса у детей с БЭН. Как было сказано выше, для детей с тяжёлой БЭН характерен избыток натрия в организме, даже если сывороточный уровень натрия снижен. Дефицит ионов калия и магния требует коррекции в течение первых 2 нед. Отёки при БЭН также связаны с электролитным дисбалансом. Для их коррекции не следует использовать диуретики, так как это может только усугубить имеющиеся нарушения и вызвать гиповолемический шок. Необходимо обеспечить регулярное поступление в организм ребёнка основных минералов в достаточном количестве. Рекомендуют использовать калий в дозе 3-4 ммоль/кг в сут, магний — по 0,4-0,6 ммоль/кг в сут. Пищу для детей с БЭН следует готовить без соли, для регидратации применяют только раствор ReSoMal. Для коррекции электролитных нарушений используют специальный электролитно-минеральный раствор, содержащий (в 2,5 л) 224 г калия хлорида, 81 г калия цитрата, 76 г магния хлорида, 8,2 г цинка ацетата, 1,4 г меди сулфата, 0,028 г натрия селената, 0,012 г калия йодида, из расчёта 20 мл этого раствора на 1 л питания.
Пятый шаг заключается в своевременном лечении и предупреждении инфекционных осложнений у детей с БЭН и вторичным комбинированным иммунодефицитом.
Шестой шаг применяют для коррекции дефицита микронутриентов, характерного для любой формы БЭН. При этом шаге необходим крайне взвешенный подход. Несмотря на достаточно высокую частоту анемии при БЭН, препараты железа в ранние сроки выхаживания не применяют. Коррекцию сидеропении проводят только после стабилизации состояния, при отсутствии признаков инфекционного процесса, после восстановления основных функций ЖКТ, аппетита и стойкой прибавки массы тела, то есть не ранее чем через 2 нед от начала терапии. Иначе данная терапия может значительно усилить тяжесть состояния и ухудшить прогноз при наслоении инфекции. Для коррекции дефицита микронутриентов необходимо обеспечить поступление железа в дозе 3 мг/кг в сут, цинка — 2 мг/кг в сут, меди — 0,3 мг/кг в сут, фолиевой кислоты (в первый день — 5 мг, а затем — 1 мг/сут) с последующим назначением поливитаминных препаратов с учётом индивидуальной переносимости. Возможно назначение отдельных витаминных препаратов:
• аскорбиновой кислоты в виде 5% раствора внутривенно или внутримышечно по 1-2 мл (50-100 мг) 5-7 раз в сут в фазу адаптации при Н-Ш степени гипотрофии или внутрь по 50-100 мг 1-2 раза в сут в течение 3-4 нед в фазу репарации;
• витамина Е — внутрь по 5 мг/кг в сут в 2 приёма во второй половине дня в течение 3-4 нед в фазу адаптации и репарации;
• кальция пантотената — внутрь по 0,05-0,1 г 2 раза в сут в течение 3-4 нед в фазу репарации и усиленного питания;
• пиридоксина — внутрь по 10-20 мг 1 раз в сут до 8 ч утра в течение 3-4 нед в фазу адаптации и репарации;
• ретинола — внутрь по 1000-5000 ЕД в 2 приёма во второй половине дня в течение 3-4 нед в фазу репарации и усиленного питания.
Седьмой и восьмой шаги включают проведение сбалансированной диетотерапии с учётом тяжести состояния, нарушенной функции ЖКТ и пищевой толерантности. Дети с тяжёлой БЭН зачастую требуют интенсивной терапии, степень нарушения их метаболических процессов и функций пищеварительной системы настолько велики, что обычная диетотерапия не способна значимо улучшить их состояние. Именно поэтому при тяжёлых формах БЭН показано проведение комплексной нутритивной поддержки с применением как энтерального, так и парентерального питания.
Парентеральное питание начального периода следует проводить постепенно с применением исключительно аминокислотных препаратов и концентрированных растворов глюкозы. Жировые эмульсии при БЭН добавляют в программы парентерального питания только спустя 5-7 дней от начала терапии из-за их недостаточного усвоения и высокого риска развития побочных эффектов и осложнений. Во избежание опасности развития тяжёлых метаболических осложнений, таких как синдром гипералиментации и синдром «возобновлённого питания» («refeeding syndrome»), при БЭН необходимо сбалансированное и минимальное парентеральное питание. Синдром «возобновлённого питания» — комплекс патофизиологических и метаболических нарушений, вызванных последовательным истощением, перенасыщением, сдвигом и нарушенным взаимодействием фосфорного, калиевого, магниевого, водно-натриевого и углеводного обмена, а также полигиповитаминозом. Последствия данного синдрома иногда бывают фатальными.
При тяжёлых формах БЭН наиболее оправданно постоянное энтеральное зондовое питание: непрерывное медленное поступление питательных веществ в ЖКТ (желудок, двенадцатиперстную кишку, тощую кишку) с их оптимальной утилизацией, несмотря на патологический процесс. Скорость поступления питательной смеси в ЖКТ не должна превышать 3 мл/мин, калорийная нагрузка — не более 1 ккал/мл, а осмолярность — не более 350 мосмол/л. Необходимо использовать специализированные продукты. Наиболее оправданно применение смесей на основе глубокого гидролизата молочного белка, обеспечивающих максимальное усвоение питательных веществ в условиях значительного угнетения переваривающей и всасывающей способности пищеварительного канала. Другое требование, предъявляемое к смесям для детей с тяжёлыми формами БЭН, — отсутствие или низкое содержание лактозы, поскольку у этих детей отмечают выраженную дисахаридазную недостаточность. При проведении постоянного энтерального зондового питания следует соблюдать все правила асептики, а при необходимости — обеспечить стерильность питательной смеси, что возможно только при применении готовых жидких питательных смесей. Поскольку энерготраты на переваривание и усвоение питательных веществ гораздо ниже, чем при болюсном введении питательной смеси, такой вид питания максимально оправдан. Этот вид диетотерапии способствует улучшению полостного пищеварения и постепенному повышению всасывающей способности кишки. Постоянное энтеральное зондовое питание нормализует моторику верхних отделов ЖКТ. Белковый компонент (независимо полуэлементная или полимерная диета) при таком питании модулирует секреторную и кислотообразующую функцию желудка, поддерживает адекватную экзокринную функцию поджелудочной железы и секрецию холицистокинина, обеспечивает нормальную моторику билиарной системы и предотвращает развитие таких осложнений, как билиарный сладж и холелитиаз. Белок, поступающий в тощую кишку, модулирует секрецию хемотрипсина и липазы. Длительность периода постоянного энтерального зондового питания варьирует от нескольких дней до нескольких недель в зависимости от выраженности нарушенной пищевой толерантности (анорексии и рвоты). Постепенно повышая калорийность пищи и изменяя её состав, осуществляют переход на болюсное введение питательной смеси при 5-7-разовом дневном кормлении с постоянным зондовым кормлением в ночное время. При достижении объёма дневных кормлений 50-70% постоянное зондовое кормление полностью отменяют.
При средней и лёгкой степени тяжести БЭН проводят традиционную диетотерапию, основанную на принципе омоложения пищи и поэтапном изменении рациона с выделением:
• этапа адаптационного, осторожного, минимального питания;
• этапа репарационного (промежуточного) питания;
• этапа оптимального или усиленного питания.
В период определения толерантности к пище осуществляют адаптацию ребёнка к её необходимому объёму и проводят коррекцию водно-минерального и белкового обмена. В репарационный период осуществляют коррекцию белкового, жирового и углеводного обмена, а в период усиленного питания повышают энергетическую нагрузку. При БЭН в начальные периоды лечения уменьшают объем и увеличивают кратность кормления (табл. 7-8). Необходимый суточный объём пищи у ребёнка с гипотрофией составляет 200 мл/кг, или 1/5 часть его фактической массы тела. Объём жидкости ограничивают 130 мл/кг в сут, а при тяжёлых отёках — 100 мл/кг в сут.
Таблица 7-8. Рекомендуемый режим кормления при белково-энергетической недостаточности на этапе «Осторожное питание» (ВОЗ, 2003)
|
День |
Частота |
Разовый объём, мл/кг |
Суточный объём, мл/кг в сут |
|
1-2 |
Через 2 ч |
11 |
130 |
|
3-5 |
Через 3 ч |
16 |
130 |
|
6-7+ |
Через 4 ч |
22 |
130 |
При I степени БЭН адаптационный период обычно длится 2-3 дня. В первый день назначают 2/3 необходимого суточного объёма пищи. В период выяснения толерантности к пище её объём постепенно увеличивают. По достижении необходимого суточного объёма пищи назначают усиленное питание. При этом количество белков, жиров и углеводов рассчитывают на долженствующую массу тела (допустим расчёт количества жиров на среднюю массу тела между фактической и долженствующей). При II степени БЭН в первый день назначают 1/2-2/3 необходимого суточного объёма пищи. Недостающий объём пищи восполняют за счёт приёма внутрь регидратационных растворов. Адаптационный период заканчивается при достижении необходимого суточного объёма пищи.
На первой неделе переходного периода количество белков и углеводов рассчитывают на массу, соответствующую фактической массе тела пациента плюс 5% её, жиров — на фактическую массу. На второй неделе количество белков и углеводов рассчитывают на фактическую массу плюс 10% её, жиров — на фактическую массу. На третьей неделе кратность кормлений соответствует возрасту, количество белков и углеводов рассчитывают на фактическую массу плюс 15% её, жиров — на фактическую массу. На четвёртой неделе количество белков и углеводов рассчитывают приблизительно на долженствующую массу тела, жиров — на фактическую.
В период усиленного питания содержание белков и углеводов постепенно увеличивают, их количество начинают рассчитывать на долженствующую массу, количество жиров — на среднюю массу между фактической и долженствующей. При этом энергетическая и белковая нагрузка на фактическую массу тела превышает нагрузку у здоровых детей. Это связано со значительным увеличением энергозатрат у детей в период реконвалесценции при БЭН (рис. 7-5). В дальнейшем диету ребёнка приближают к нормальным параметрам за счёт расширения ассортимента продуктов, увеличения суточного объёма принимаемой пищи и уменьшения числа кормлений. Меняют состав применяемых смесей (табл. 7-9), увеличивают калорийность и содержание основных питательных веществ.
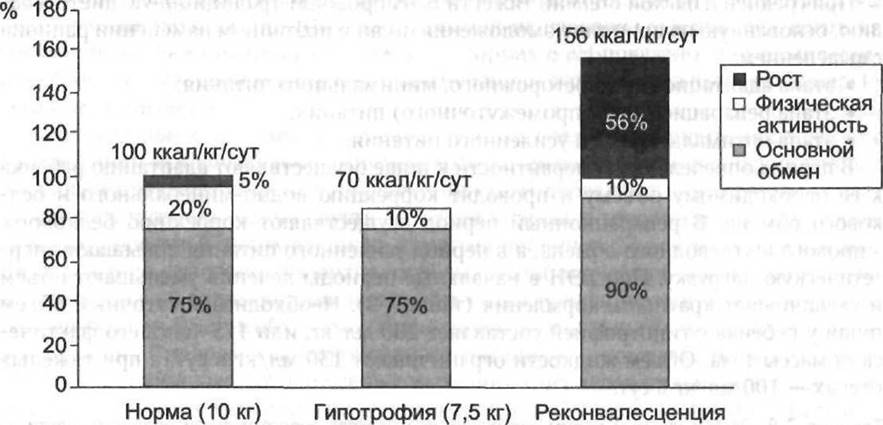
Рис. 7-5. Энергетические затраты у детей на разных стадиях белково-энергетической недостаточности (Goulet 0., 1998, с модификацией).
В период усиленного питания используют гиперкалорические питательные смеси. Коррекцию потребления белка проводят творогом, белковыми модулями; потребления жиров — жировыми модульными смесями, сливками, растительным или сливочным маслом; потребления углеводов — сахарным сиропом, кашами (по возрасту).
Таблица 7-9. Примерный состав молочных смесей* (ВОЗ, 2003)
|
F-75 (стартовая) |
F-100 (последующая) |
F-135 (последующая) |
|
|
Энергия, ккал/100 мл |
75 |
100 |
135 |
|
Белок, г/100 мл |
0,9 |
2,9 |
3,3 |
|
Лактоза, г/100 мл |
1,3 |
4,2 |
4,8 |
|
К, ммоль/100 мл |
4,0 |
6,3 |
7,7 |
|
Na, ммоль/100 мл |
0,6 |
1,9 |
2,2 |
|
Мд, ммоль/100 мл |
0,43 |
0,73 |
0,8 |
|
Zn, мг/100 мл |
2,0 |
2,3 |
3,0 |
|
Си, мг/100 мл |
0,25 |
0,25 |
0,34 |
|
Доля энергии белков, % |
5 |
12 |
10 |
|
Доля энергии жиров, % |
36 |
53 |
57 |
|
Осмолярность, мосмол/л |
413 |
419 |
508 |
* Для бедных развивающихся стран.
Объём кормления следует увеличивать постепенно под строгим контролем состояния ребёнка (пульс и частота дыхания). Если в течение 2 последующих 4-часовых кормлений частота дыхания увеличивается на 5 в мин, а частота пульса увеличивается на 25 и более в мин, то объём кормления снижают, а последующее увеличение объёма разового кормления замедляют (16 мл/кг на кормление — 24 ч, затем 19 мл/кг на кормление — 24 ч, затем 22 мл/кг на кормление — 48 ч, затем повышая каждое последующее кормление на 10 мл). При хорошей переносимости на этапе усиленного питания обеспечивают высококалорийное питание (150-220 ккал/кг в сут) с повышенным содержанием нутриентов, однако количество белков не превышает 5 г/кг в сут, жиров — 6,5 г/кг в сут, углеводов — 14-16 г/ кг в сут. Средняя длительность этапа усиленного питания составляет 1,5-2 мес.
Основной показатель адекватности диетотерапии — прибавка массы тела. Хорошей считают прибавку, превышающую 10 г/кг в сут, средней — 5-10 г/кг в сут и низкой — менее 5 г/кг в сут. Возможные причины плохой прибавки массы тела:
• неадекватное питание (отсутствие ночных кормлений, неправильный расчёт питания или без учёта прибавки массы, ограничение частоты или объёма питания, несоблюдение правил приготовления питательных смесей, отсутствие коррекции при грудном или обычном питании, недостаток ухода за ребёнком);
• дефицит специфических нутриентов, витаминов;
• текущий инфекционный процесс;
• психические проблемы (руминация, вызывание рвоты, отсутствие мотивации, заболевания психики).
Девятый шаг предусматривает сенсорную стимуляцию и эмоциональную поддержку. Дети с БЭН нуждаются в нежном, любящем уходе, ласковом общении родителей с ребёнком, проведении массажа, лечебной гимнастики, регулярных водных процедур и прогулках на свежем воздухе. С детьми необходимо играть в течение не менее 15-30 мин в сут. Наиболее оптимальная температура воздуха для детей с БЭН — 24-26 °С при относительной влажности 60-70%.
Десятый шаг предусматривает длительную реабилитацию, включающую:
• питание, достаточное по частоте и объёму, адекватное по калорийности и содержанию основных нутриентов;
• хороший уход, сенсорную и эмоциональную поддержку;
• регулярные медицинские осмотры;
• адекватную иммунопрофилактику;
• витаминную и минеральную коррекцию.
Фармакотерапия тесно связана с диетической коррекцией. Заместительную терапию назначают всем детям с БЭН. В состав этой терапии входят ферменты, наиболее оптимальны микросферические и микрокапсулированные формы панкреатина. Ферментные препараты назначают длительно из расчёта 1000 ЕД/кг в сут липазы в 3 приёма во время еды или в основные приёмы пищи. Обязательное условие при лечении БЭН — назначение витаминно-микроэлементных препаратов (шаг 6). В фазу адаптации, а также в другие фазы при низкой толерантности к пище или при отсутствии прибавки массы тела оправдано назначение инсулина из расчёта 1 ЕД на 5 г в сочетании с внутривенным введением концентрированных растворов глюкозы. В фазу восстановления метаболизма, при постоянной прибавке массы тела для её закрепления и некоторой стимуляции показано назначение других лекарственных средств с анаболическим эффектом:
• инозина — внутрь до еды по 10 мг/кг в сут в 2 приёма во второй половине дня в течение 3-5 нед;
• оротовой кислоты, калиевой соли — внутрь до еды по 10 мг/кг в сут в 2 приёма во второй половине дня в течение 3-5 нед в фазу усиленного питания при удовлетворительной толерантности к пище (или на фоне приёма ферментных препаратов), при плохой прибавке массы тела;
• левокарнитина — 20% раствор внутрь за 30 мин до еды по 5 капель (недоношенным детям), по 10 капель (детям до года), по 14 капель (детям от 1 года до 6 лет) 3 раза в день в течение 4 нед;
• или ципрогептадина внутрь по 0,4 мг/кг 1 раз в сут в 20-21 ч в течение 2 нед.
При выраженном дефиците массы тела и роста на фоне заместительной (базовой) терапии витаминами и ферментами (в случае отставания костного возраста от паспортного) назначают нандролон внутримышечно по 0,5 мг/кг 1 раз в мес в течение 3-6 мес.
ПРОГНОЗ
При первичных алиментарно-зависимых формах БЭН прогноз, как правило, благоприятный. Часто неблагоприятный прогноз отмечают у детей с вторичными формами БЭН, особенно генетически детерминированными. Наиболее тяжёлый прогноз характерен для хромосомной патологии. Так, при синдромах Патау и Эдвардса в большинстве случаев дети не доживают до года.
ИЗБЫТОЧНАЯ МАССА ТЕЛА И ОЖИРЕНИЕ
Синоним — алиментарное ожирение.
ОПРЕДЕЛЕНИЕ
Ожирение (лат. adipositas) — хроническое расстройство питания, характеризующееся избыточным накоплением жировой ткани в организме.
В настоящее время термины «ожирение» и «избыточная масса тела» одинаково часто используют в педиатрии, причём термин «избыточная масса тела» более предпочтителен.
КОДЫ ПО МКБ-10
Е65-Е68. Ожирение и другие виды избыточности питания.
Е66. Ожирение.
Е66.0. Ожирение, обусловленное избыточным поступлением энергетических ресурсов.
Е66.8. Другие формы ожирения.
Е66.9. Ожирение неуточнённое.
Е68. Последствия избыточности питания.
ЭПИДЕМИОЛОГИЯ
В экономически развитых странах, включая Россию, 16% детей уже имеют ожирение и 31% входят в группу риска по формированию этой патологии, встречающейся у девочек чаще, чем у мальчиков.
По данным Европейского регионарного бюро ВОЗ (2007), за последние двадцать лет распространённость ожирения увеличилась в 3 раза, достигнув масштабов эпидемии. По данным эпидемиологических исследований, при наличии ожирения у отца вероятность его развития у детей составляет 50%, при наличии этой патологии у матери — 60%, а при наличии у обоих родителей — 80%.
Причинами эпидемии ожирения считают изменение состава питания (увеличение потребления энергетически богатой пищи), пищевых привычек (питание в фаст-фудах, частое использование готовых сухих завтраков), недостаточное потребление фруктов и овощей, резкое уменьшение физической активности.
ПРОФИЛАКТИКА
Ожирение, диагностированное в детском возрасте, сохраняется у 2/3 подростков, а частота его выявления возрастает в 3-4 раза.
Как установлено в ходе 10-летнего проспективного наблюдения за динамикой основных факторов риска сердечно-сосудистых заболеваний, более половины обследуемых сохранили избыточную массу тела и треть — гиперхолестеринемию; у каждого четвёртого отмечен высокий уровень холестерина ЛПВП и у каждого пятого - высокий уровень триглицеридов. Повышенное систолическое АД через 10 лет оставалось таковым в 20,6%, а повышенное диастолическое АД -
в 15,8% случаев. Установлено, что частота повышенного АД у лиц мужского пола увеличивается с 4,3% в 11-12 лет до 6,7% в 21-23 года, в 3 раза увеличивается частота избыточной массы тела (с 4,3 до 13,5%); более чем в 4 раза — частота низкого уровня холестерина ЛПВП (с 5,5 до 24,2%), резко возрастает частота регулярного курения (с 0 до 67,7%). У каждого шестого в возрасте 21-23 лет уровень холестерина повышен. Если в 11-12 лет более 70% обследуемых не имело основных факторов риска, то в 21-23 года их количество достигает лишь 4,8%, а у 2/3 обследуемых в этом возрасте наблюдалось 2 и более факторов риска.
Выделяют 3 критических периода, определяющих высокую вероятность ожирения во взрослой жизни.
Ранний возраст. Несмотря на возможность благоприятного исхода при нормализации рациона питания в этот период, быстрое увеличение массы тела или его имеющийся избыток на первом году жизни служит фактором риска развития ожирения.
Препубертат (5-7 лет). Ожирение, развившееся в этот период, как правило, оказывается стойким и предопределяет постоянное ожирение во взрослой жизни.
Подростковый возраст. Явное большинство подростков с избыточной массой тела сохраняет её и во взрослом возрасте. Ожирение, развившееся на фоне нейро-гормональной перестройки, в дальнейшем формирует осложнённое ожирение или так называемый гипоталамический синдром периода полового созревания.
Учитывая вышесказанное, меры профилактики следует применять на всех этапах развития ребёнка, особенно у детей с наследственной предрасположенностью к ожирению. В период беременности рекомендуют исключение курения, выполнение физических упражнений, контроль уровня глюкозы крови. До начала беременности желательна нормализация массы тела женщины. В период новорождённости и раннего возраста предпочтительно грудное вскармливание (хотя бы до 3 мес), позднее введение прикорма и подслащённых напитков.
В семье следует принимать пищу в фиксированное время и в отведённом для питания месте. Нельзя пропускать приёмы пищи, особенно завтрак. Не рекомендуют просмотр телевизора во время еды. Следует использовать маленькие тарелки и убирать со стола посуду, где приготовлена пища, т.е. сразу накладывать порции. Желательно избегать лишней сладкой и жирной пищи и подслащённых напитков. Не следует держать телевизор в детской комнате, необходимо уменьшить время просмотра телевизионных передач и компьютерных игр.
Профилактику необходимо продолжать и в школе, внедряя социальные и медицинские программы здорового образа жизни.
СКРИНИНГ
Систематический (раз в квартал) мониторинг массо-ростовых показателей с определением ИМТ, а также АД.
КЛАССИФИКАЦИЯ
Общепринятой классификации ожирения в настоящее время нет. У взрослых диагноз ожирения основан на расчёте ИМТ [отношение массы тела (в килограммах) к росту человека (в метрах), возведённому в квадрат]. По ИМТ можно переоценить тучность тренированных спортсменов или мускулистых детей, тем не менее расчёт ИМТ - наиболее надёжный и достоверный метод определения избыточной массы тела. Используют и другие методы оценки тучности, но они либо очень дороги (УЗИ, КТ, МРТ, рентгеновская абсорбциометрия), либо требуют специального оборудования (калипер), либо плохо воспроизводятся (измерение объёма талии и бёдер), либо не имеют нормативов для детского возраста (биоэлектрический импедансный анализ).
У детей оценку показателя ИМТ проводят с учётом возраста и пола по рекомендованным нормам. За норму массы тела принимают её значение для соответствующего
возраста. Эти нормативы рекомендованы ВОЗ (Expert Committee on Clinical Guidelines for Overweight in Adolescent Preventive Services и European Childhood Obesity Group) в качестве критерия для определения избыточной массы тела в детском возрасте.
В настоящее время антропометрические показатели оценивают преимущественно 2 способами: параметрическим, или сигмальным, и непараметрическим — дентальным.
Параметрическая шкала включает среднюю арифметическую («норму») и отклонения от неё, измеряемые величиной «сигма» (σ — среднее квадратичное отклонение, standard deviation — SD). Для оценки степени отличия исследуемого параметра от средних значений рассчитывают коэффициент стандартного отклонения (standard deviation score — SDS). Показатель m±SD — область средних величин, свойственных примерно 68% здоровых детей. Величина SDS составляет от +1 до -1.
При избыточной массе тела SDS соответствует +1-+2, при ожирении — +2 и более. В группе детей с ожирением различают две подгруппы:
• умеренное ожирение — SDS = 2,02-2,35;
• морбидное (тяжёлое) ожирение — SDS = 2,36-3,52.
Имеются специальные программы, например Growth Analyser 3.5, Dutch Growth Foundation, которые оценивают в единицах SDS.
Преимущество метода заключается в возможности оценки и описания резко выраженных отклонений, чаще всего характеризующих эндокринную патологию. Величины в пределах от +2 SD (SDS=+2) до -2 SD (SDS=-2) приблизительно соответствуют величинам от 97-го до 3-го цента ля.
Дентальные таблицы (или графики) показывают количественные границы роста и массы тела у определённой доли, или процента (центиля), детей в зависимости от возраста. Поскольку центильный метод не ограничен характером распределения, он применим для оценки любых показателей. Метод прост в работе, поскольку при использовании центильных таблиц, или графиков, исключены какие-либо расчёты (см. табл. 7-10).
Таблица 7-10. Классфикация индекса массы тела у детей и подростков (ВОЗ)
|
Перцентили ИМТ по возрасту |
Диагноз |
|
Меньше 5 |
Дефицит массы тела |
|
5-84 |
Нормальная масса тела |
|
85-94 |
Избыточная масса тела |
|
95 и выше |
Ожирение |
У детей первых 2 лет жизни используют перцентильные таблицы стандартов роста, массы тела и окружности головы отдельно для девочек и мальчиков, составленные на основании измерения репрезентативной когорты детей европейской популяции. Показатели роста и массы тела, полученные на указанной популяции детей, полностью согласуются с данными И.М. Мазурина и соавт., полученными при обследовании русской популяции детей.
Перцентили роста (массы тела, окружности головы) — средние значения (медиана показателя соответствует 50 перцентиль) и отклонения от медианы, 3 перцентиль соответствует нижней границе нормы (-2 SD от среднего значения), а 97 перцентиль — верхней границе нормы (+2 SD от среднего значения).
ЭТИОЛОГИЯ
У подавляющего большинства детей ожирение не связано с наследственными или эндокринными болезнями, хотя роль наследственной предрасположенности к ожирению считают установленной. Ведущее значение в формировании положительного энергетического баланса имеют генетически детерминированные особенности обмена веществ и строение жировой ткани:
• повышенное количество адипоцитов и их ускоренная дифференцировка из фибробластов;
• врождённая повышенная активность ферментов липогенеза и сниженная — липолиза;
• повышение интенсивности образования жира из глюкозы;
• сниженное образование лептина в адипоцитах или дефект рецепторов к нему.
К повышению массы тела приводят:
• избыточное питание матери во время беременности;
• искусственное вскармливание ребёнка на первом году жизни;
• повышенное употребление высококалорийных продуктов питания промышленного производства;
• редкие приёмы пищи, преимущественно во второй половине дня;
• сформировавшаяся привычка к перееданию.
Хронический стресс (конфликты в семье, сложные детско-родительские отношения, трудности при обучении в школе) практически всегда компенсируется изменением пищевого поведения ребёнка в виде повышенного аппетита, учащения приёмов пищи, больших объёмов принимаемой пищи. Роль пищевых привычек в формировании ожирения у детей дошкольного и школьного возраста установлена.
К снижению физической активности приводят:
• сидячий образ жизни;
• длительный просмотр телепередач;
• увлечение компьютером;
• повсеместное использование автотранспорта с ограничением пешеходных прогулок.
ПАТОГЕНЕЗ
Один из основных патогенетических механизмов развития ожирения у детей — энергетический дисбаланс: энергия потребления превышает энергию расхода. Как установлено в настоящее время, в основе патогенеза ожирения лежит не только энергетический, но и дисбаланс нутриентов. Ожирение прогрессирует, если организм не способен обеспечить окисление поступающего жира.
Патогенез ожирения не зависит от его причины. Относительный или абсолютный избыток пищи, особенно богатой углеводами, приводит к гиперинсулинизму. Возникающая вследствие этого гипогликемия поддерживает чувство голода. Инсулин — главный липогенетический гормон — способствует синтезу триглицеридов в жировой ткани, а также оказывает анаболическое действие (рост и дифференцировка жировой и костной ткани).
Избыточное накопление жира сопровождается вторичным изменением функции гипоталамуса: повышением секреции адренокортикотропного гормона (АКТГ) и гиперкортицизмом, нарушением чувствительности вентромедиальных и вентро-латеральных ядер к сигналам голода и сытости, перестройкой функции других эндокринных желёз, центров терморегуляции, регуляции АД, нарушением секреции нейропептидов и моноаминов ЦНС, пептидов ЖКТ и т.д.
Ожирение рассматривают как хронический воспалительный процесс, в его генезе важную роль играют цитокины жировой ткани: ФНО-а, интерлейкины (1,6, 8), a также изменения липидного состава сыворотки крови и активация процессов липопероксидации.
Адипоциты жировой ткани выделяют лептин, ферменты, регулирующие липопротеиновый метаболизм (липопротеиновую липазу, гормоночувствительную липазу), и свободные жирные кислоты. Существует механизм обратной связи между уровнем лептина и выработкой гипоталамического нейропептида Y. Проникнув в гипоталамус, лептин контролирует потребление пищи через лимбическую долю и ствол мозга. Однако при нарушении функционального состояния системы, контролирующей массу тела, и сниженной чувствительности лептиновых рецепторов гипоталамуса «пищевой центр» не реагирует на лептин и чувство насыщения после приёма пищи отсутствует. Содержание лептина в организме связано с содержанием инсулина.
В регуляции деятельности центров голода и насыщения участвуют инсулин, холецистокинин, а также биогенные амины: норадреналин и серотонин, играющие важную роль не только в регуляции собственно приёма пищи, но и в выборе продуктов, наиболее предпочтительных для данного человека. В реализации механизма пищевого термогенеза участвуют тиреоидные гормоны. Активное регуляторное воздействие на пищевое поведение оказывают энтеральные гормоны двенадцатиперстной кишки. При низкой концентрации энтеральных гормонов аппетит после приёма пищи не снижается.
Повышение аппетита может быть связано с высокой концентрацией нейро-пептида-χ или эндогенных опиатов (эндорфинов).
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА Анамнез
Анамнестические диагностические критерии:
• сахарный диабет (в том числе гестационный), метаболический синдром у матери, ожирение у родственников;
• большая масса тела у ребёнка при рождении;
• масса тела при рождении менее 2500 г;
• ранний возраст перестройки жировой ткани (быстрое увеличение ИМТ к 5-6 годам);
• высококалорийное питание преимущественно во второй половине дня, привычка к перееданию.
Физикальное обследование
Диагностические критерии:
• определение ИМТ;
• признаки избыточного развития подкожно-жировой клетчатки, определённый характер распределения жира;
• признаки трофических нарушений кожи;
• симптомы поражения сердечно-сосудистой системы, пищеварения (ГЭРБ, стеатогепатит), органов дыхания (апноэ во сне), опорно-двигательного аппарата;
• симптомы нарушения полового развития: признаки ложной гинекомастии и гипогенитализма у мальчиков;
• проявления психопатических, невротических и вегетативных нарушений.
Лабораторные исследования
Результаты общего анализа крови и мочи не имеют специфических изменений.
Биохимический анализ крови обнаруживает:
• повышение уровня холестерина, триглицеридов, липопротеинов низкой плотности, свободных жирных кислот;
• снижение содержания липопротеинов высокой плотности;
• ацидоз;
• гиперинсулинемический тип гликемической кривой.
Проводят исследование крови на гормоны (по показаниям).
Инструментальные исследования
Исследование включает:
• ЭКГ, кардиоинтервалографию;
• УЗИ органов брюшной полости и почек, щитовидной железы;
• фиброгастродуоденографию;
• МРТ головного мозга;
• исследование функции внешнего дыхания.
Проводят суточный мониторинг АД.
Дифференциальная диагностика
Дифференциальную диагностику избыточной массы тела проводят с различными формами вторичного ожирения, вызванного:
• генетическими синдромами, протекающими с ожирением:
❖ Прадера-Вилли;
❖ Шерешевского-Тернера;
❖ Дауна;
❖ Лоуренса-Муна-Барде-Бидля; о Альстрома;
❖ Карпентера;
• мутацией гена рецептора лептина или меланокортина 4;
• миодистрофией;
• миелодисплазией;
• дефицитом про-опиомеланокортина;
• псевдогипопаратироидизмом;
• органическими поражениями ЦНС, ассоциированными с повреждением ядер вентромедиальной и латеральной областей гипоталамуса, регулирующих аппетит и насыщение;
• последствиями черепно-мозговой травмы;
• эндокринными заболеваниями:
❖ гипотиреозом;
❖ гипогонадизмом;
❖ гиперкортицизмом;
❖ гиперинсулинизмом;
❖ юношеским диспитуитаризмом;
❖ ятрогенными факторами: использованием некоторых лекарственных препаратов (например, анаболиков, ГК).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Детям с ожирением необходима консультация медицинского генетика и эндокринолога для исключения наследственных и эндокринных заболеваний, требующих специализированного лечения. При наличии у детей аффективных расстройств показана консультация медицинского психолога и психиатра. Если у ребёнка имеются проявления сердечной аритмии, рекомендована консультация кардиолога.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Избыточная масса тела.
ЛЕЧЕНИЕ
Цель лечения: достижение энергетического равновесия между потреблением энергии и её расходом. Критерием эффективности лечения ожирения у детей служит снижение массы тела. Необходимое условие проведения диетотерапии во всех возрастных группах — расчёт питания по белкам, жирам, углеводам, а также по калориям с сопоставлением фактического и рекомендуемого потребления.
Детям, склонным к ожирению, родившимся с большой массой тела или имеющим большие прибавки массы тела, в качестве первого прикорма вводят овощные пюре с ограничением картофеля. При введении второго и третьего прикорма кашу (преимущественно гречневую или овсяную) дают не более одного раза в день. Для улучшения вкуса растворимых каш (без соли и сахара) рекомендуют добавлять яблоки, тыкву, морковь (при отсутствии аллергических реакций) и сухофрукты. Готовые фруктовые соки и пюре желательно приобретать без сахара. Менее сладкие овощные соки предпочтительнее фруктовых.
Лечение ожирения у детей первого года жизни состоит исключительно в диетотерапии. Рекомендуют строгое соблюдение возрастных норм питания, исключение сладкого, «перекусов» и сладких напитков.
Рацион ребёнка старше года должен содержать мясо нежирных сортов (говядину, телятину, мясо кролика, цыплят, кур), рыбу тресковых пород и яйца. Детям с избыточной массой тела необходимо ежедневно получать молоко и молочные продукты (предпочтительно в виде кисломолочных напитков, например, кефира, лучше пониженной жирности, простокваши), нежирный творог, сыры. Следует ограничить употребление молока и молочных продуктов с повышенным содержанием жира (молока 6% жирности, сливок, сметаны, некоторых жирных сортов сыра). Желательно употреблять в пищу овощи с низким содержанием углеводов (капусту, огурцы, редис, салат, томаты), несладкие фрукты, соки, ягоды, зерновой хлеб и хлебобулочные изделия из муки грубого помола. Необходимо ограничивать употребление сахара, мёда, варенья, выпечки, копчёностей, тугоплавких жиров.
В рационе детей с избыточной массой тела после 3 лет возможны некоторые ограничения, не затрагивающие суточных потребностей растущего организма в белках, жирах, углеводах и витаминах. Ограничение количества жира в рационе зависит от степени избыточной массы тела ребёнка (в пределах 15-30%). Для снижения аппетита и притупления чувства голода исключают вкусовые приправы, пряности, экстрактивные вещества, острые, копчёные и солёные закуски. Максимально ограничивают употребление фаст-фуда и сладких газированных напитков.
Принцип питания школьников, страдающих избыточной массой тела, такой же, как у детей дошкольного возраста. Соблюдения элиминационных диет не рекомендуют, так как при этом ребёнок лишается питательных веществ, необходимых для оптимального роста и развития. Детям необходимо заниматься каким-либо видом спорта, связанным с активными движениями: плаванием, лыжами и др. При большой степени ожирения необходимы занятия лечебной физкультурой.
Диетотерапия у подростков основана на осознании её необходимости и изменения образа жизни при соблюдении адекватного поступления в организм эссенциальных нутриентов. Не следует применять агрессивных и жёстких методов воздействия, связанных с напряжёнными физическими упражнениями или строгой диетой, а изменение образа жизни требует обязательного активного участия родителей.
Обучение навыкам самоконтроля побуждает детей устанавливать собственные цели, касающиеся режима питания (контроль над количеством и составом принимаемой пищи, а также за теми, кто разделяет с ними трапезу), массы тела и физических упражнений.
В подростковом возрасте можно предложить план питания на 1500 ккал (то есть на 12 углеводных единиц — УЕ), изменяемый в зависимости от индивидуальных особенностей пациента и целей лечения.
ПРОГНОЗ
Прогноз для жизни благоприятный.
ЗАКЛЮЧЕНИЕ
В заключение главы авторы обращают внимание практикующих врачей на неоправданно широкое использование описательных диагнозов и терминов, отсутствующих в МКБ-10:
• «нормотрофия» («эйтрофия», предложен туром);
• «гипоплазия» (предложен Сперанским);
• «гипотрофия» (введён в 1900 г.).
При работе с детьми до 1,5-2 лет педиатры применяют термин «паратрофия». Паратрофия («мучная болезнь», «мучное расстройство питания», псевдоупитанность) впервые описана А. Черни у детей, переведённых на одностороннее питание мучными продуктами (мучные отвары или супы без добавок масла и молока) вследствие недостатка молока. Этот термин лишь констатирует наличие у ребёнка избыточной массы тела. В подавляющем большинстве случаев причиной излишней массы тела служит переедание в сочетании с недостаточной подвижностью.
В качестве симптомов отмечают:
• повышенную гидрофильность тканей;
• мышечную гипотонию;
• снижение тургора тканей;
• бледность и пастозность кожи;
• нарушение терморегуляции;
• вялость;
• низкую активность;
• неустойчивость эмоционального тонуса;
• поверхностный сон;
• отставание в психомоторном развитии;
• избирательный аппетит;
• частые инфекционные заболевания с затяжным течением.
Респираторные заболевания нередко рецидивируют, протекают с бронхообструктивным синдромом. У многих детей наблюдают аллергодерматозы.
В большинстве случаев выраженность паратрофии уменьшается после того, как ребёнок начинает ходить.
Возможные причины патологической прибавки массы тела у детей раннего возраста:
• макросомия новорождённых;
• синдром Беквита-Видемана;
• гипотиреоз;
• гиперкортицизм;
• тимомегалия;
• адреногенитальный синдром.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Дедов И.И., Петеркова В.А. Руководство по детской эндокринологии. — М.: Универсум Паблишинг, 2006. — С. 448-475.
Доценко В.А., Мосийчук Л.В., Парамонов А.Е. Ожирение у детей и подростков: современные аспекты // Вопросы детской диетологии. — 2004. — Т. 2. — № 3. — С. 25-32.
Основы клинического питания: Материалы лекций для курсов Европейской ассоциации парентерального и энтерального питания: Пер. с англ. / Гл. ред. Л. Соботка. — 2-е изд. — Петрозаводск: ИнтелТек, 2003. — 416 с.
Оценка питательного статуса у детей: Пособие для врачей / Под ред. проф. Л.Е. Цыпина, проф. А.А. Корсунского. — М.: РГМУ, 2005. — 44 с.
Современные специальные энтеральные питательные смеси и алгоритмы их применения в нутритивной поддержке у детей при оказании неотложной медицинской помощи: Учебное пособие для врачей. — М.: РГМУ, 2006. — 68 с.
Шабалов Н.П. Детские болезни: Учебник. — 6-е изд.: В 2 т. — Т. 2. - СПб.: Питер, 2007. — С. 477.
Baird J. et al. Being big or growing fast: systematic review of size and growth in infancy and later obesity // British Medical Journal. — 2005. — 331: 929.
Pediatric nutrition in chronic diseases and developmental disorders: prevention, assessment, and treatment / Edited by Shirley Walberg Ekvall, Valli Ekvall. — 2 ed. — New York: Oxford University Press. — 2005. — 532 p.
World Health Organization: Guigelines for the inpatient treatment of severely malnurished children. — Geneva: WHO, 2003.