Трансплантация гемопоэтических стволовых клеток (ТГСК) — процедура, позволяющая лечить многие тяжёлые врождённые и приобретённые заболевания, эффективного альтернативного лечения которых не существует. Больных с любым заболеванием, которое может быть излечено высокодозной химиотерапией и/или восстановлением полноценной функции зрелых потомков стволовых клеток (эритроцитов, лимфоцитов, гранулоцитов, макрофагов), можно рассматривать в качестве кандидатов на ТГСК. Количество процедур трансплантации в мире постоянно возрастает, достигая в последние годы порядка 40 000 в год, из которых не менее четверти проводят детям.
Существует два вида ТГСК:
• аллогенная трансплантация (алло-ТГСК), при которой в качестве трансплантата используют гемопоэтические клетки от семейного или совместимого неродственного донора;
• аутологичная (ауто-ТГСК), в случае которой трансплантируют собственный материал больного.
ПОКАЗАНИЯ
В табл. 19-1 приведены заболевания, при которых показана ТГСК.
Таблица 19-1. Заболевания, потенциально излечимые при помощи трансплантации гемопоэтических стволовых клеток
|
Врождённые |
Приобретённые |
|
|
злокачественные |
незлокачественные |
|
|
Врождённые иммунодефицитные состояния с дефектом |
Острый миелобластный лейкоз (ОМЛ) |
АА |
|
Пароксизмальная ночная гемоглобинурия |
||
|
Т-клеточного звена |
Острый лимфобластный лейкоз |
|
|
Гемофагоцитарные лимфогистиоцитозы |
(ОЛЛ) |
Гистиоцитарные синдромы (гистио- |
|
Хронический миелолейкоз (ХМЛ) |
цитоз из клеток Лангерганса, син- |
|
|
Врождённые и наследственные моно-, ди- и трёхростковые аплазии |
Неходжкинские лимфомы |
дромы активации макрофагов) |
|
Болезнь Ходжкина |
Истинная эритроцитарная аплазия |
|
|
Миелодиспластические синдромы |
Аутоиммунные синдромы: |
|
|
Гемоглобинопатии и талассеминеские синдромы Болезни накопления (мукопо- лисахаридозы, муколипидозы, лизосомальные болезни) Остеопетроз |
Нейробластома |
• СКВ |
|
Другие опухоли |
• склеродермия: • ревматоидный артрит; • рассеянный склероз; • ИТП; • синдром Фишера-Эванса |
|
Необходимо отметить, что приведён неполный список. Кроме того, допустим его пересмотр, поскольку появление эффективных и менее агрессивных методов медикаментозного лечения может либо перемещать трансплантацию во вторую линию терапии, либо делать её вовсе ненужной. Яркое тому подтверждение — высокая эффективность стандартной химиотерапии ОЛЛ у детей, лечение промиелоцитарного лейкоза, основанное на комбинации химиотерапии и ATRA, а также начальный опыт генной терапии некоторых врождённых синдромов. Исследования в области геномики и протеомики онкологических заболеваний создают предпосылки для получения новых эффективных лекарственных средств с помощью молекулярно направленного синтеза. О перспективности подобных препаратов свидетельствуют, например, среднесрочные результаты клинических испытаний иматиниба (гливека*) против ХМЛ.
Показаний для аутологичной трансплантации существенно меньше, чем для аллогенной. Ауто-ТГСК показана главным образом при солидных опухолях. Генетические синдромы (иммунодефициты, гемоглобинопатии, нейтропении и подобные им заболевания) лежат вне области применения аутологичных трансплантаций. При злокачественных гомеопатиях проводят преимущественно алло- ТГСК. Необходимо отметить, впрочем, что в случае лечения сверхвысокими дозами химиопрепаратов, непереносимыми без трансплантации гемопоэтических стволовых клеток, аутотрансплантации производят положительный эффект. В табл. 19-2 приведены показания для того или иного вида ТГСК в случае синдромов, связанных с нарушениями функционирования гемопоэтической ткани у детей.
Таблица 19-2. Показания к трансплантации гемопоэтических клеток у детей со злокачественными гемопатиями
|
ОЛЛ |
||
|
1 ПР |
Ph' (+) Рефрактерные к индукционной терапии t(4;11) ? |
Никто |
|
>2 ПР |
Все, кроме поздних экстрамедуллярных рецидивов |
? |
|
Рефрактерный рецидив |
Никто |
Никто |
ОМЛ
|
1 ПР |
Все, кроме t(15;17), t(8;21) inv16 |
? |
|
>2 ПР |
Все |
Все |
|
Рефрактерный рецидив без лейкемических клеток в периферической крови |
Все |
Никто |
|
Рефрактерный рецидив с лейкемическими клетками в периферической крови |
Никто |
Никто |
|
Рецидив после ТГСК |
Все |
Никто |
ХМЛ
Окончание табл. 19-2
|
Хроническая фаза, фаза акселе- |
Все |
7 |
|
рации |
||
|
Властный криз (лучше после |
Все |
7 |
|
реставрации хронической фазы) |
Злокачественные лимфомы
|
1 ПР |
При неполном ответе на первые 2-3 курса химиотерапии |
При неполном ответе на первые 2-3 курса химиотерапии |
|
Неполная ремиссия |
Все |
Все |
|
>2 ПР |
Все |
Все |
|
Первичная резистентность |
Все |
Все |
|
Рефрактерный рецидив |
Никто |
Никто |
Болезнь Ходжкина
|
1 ПР |
Никто |
Никто |
|
Неполная ремиссия |
Все |
|
|
2 ПР |
Ранний рецидив |
|
|
Химиочувствительный рецидив |
HLA-геноидентичные |
Все |
|
Рефрактерный рецидив |
Немиелоаблативные режимы |
Никто |
В педиатрии показания к трансплантации не ограничены злокачественными гемопоэтическими и негемопоэтическими опухолями и синдромами костномозговой недостаточности, а включают множество наследственных синдромов, связанных с нарушением функции как гемопоэтической, так и негемопоэтических тканей. Ниже приведены наследственные синдромы, корригируемые ТГСК.
• Успешно корригируемые (абсолютные показания к трансплантации),
❖ Дефекты лимфоидного звена:
- ретикулярная дисгенезия;
- Х-сцепленная тяжёлая комбинированная иммунная недостаточность Т(-) В(+) (дефицит общей уцепи рецепторов IL-2, IL-7, IL-15);
- дефицит аденозин дезаминазы;
- дефицит пуриннуклеозид фосфорилазы;
- гипер IgM синдром (дефицит CD40-лиганда, дефект проведения сигнала CD40- CD40-L);
- синдром Ди Георге;
- синдром Вискотта-Олдрича;
- синдром Луи-Бар;
- синдром Чедиака-Хигаси;
- синдром Гриселли;
- семейный гемофагоцитарный лимфогистиоцитоз;
- тяжёлая комбинированная иммунная недостаточность с дисплазией хрящей и волос;
- аутоиммунный лимфопролиферативный синдром;
- Х-сцепленный лимфопролиферативный синдром (синдром Пуртильо).
❖ Нарушения продукции и функции гранулоцитов:
- синдром Костманна;
- хроническая гранулёматозная болезнь;
- аутосомно-доминантный агранулоцитоз.
❖ Синдромы костномозговой недостаточности:
- АФ;
-АДБ;
- синдром Швахмана-Даймонда;
- амегакариоцитарная тромбоцитопения;
- наследственный дискератоз.
❖ Талассемии и гемоглобинопатии:
- большая талассемия и гомозиготная серповидно-клеточная анемия.
❖ Дефекты тромбоцитов:
- тромбастения Гпанцмана.
❖ Лизосомальные болезни и другие нарушения обмена:
- синдром Гурлера;
- синдром Санфилиппо В;
- болезнь Гоше;
- болезнь Фабри;
- болезнь Рефсума;
- метахроматическая лейкодистрофия;
- синдром Вольмана;
- фукозидоз;
- синдром Оммена;
- болезнь Нимана-Пика В.
• Частично корригируемые (относительные показания к трансплантации).
❖ Болезнь Гюнтера.
❖ Синдром Санфилиппо А.
❖ Синдром Моркио В.
❖ Синдром Марото-Лами.
❖ Адренолейкодистрофия.
❖ Болезнь Леша-Нихана.
• Потенциально корригируемые (отсутствие достаточного количества наблюдений).
❖ Циклическая нейтропения.
❖ Синдром ленивых лейкоцитов.
❖ Аутосомно-рецессивный остеопетроз.
❖ Хронический кожно-слизистый кандидиаз.
❖ Дефекты красного ростка:
- АДБ;
- мембранопатии с тяжёлым гемолизом;
- эритропоэтическая порфирия;
- ферментопатии (дефицит пируваткиназы, тяжёлый дефицит глюкозо-6 фосфат дегидрогеназы);
- не HbS гемоглобинопатии.
❖ Дефекты фагоцитоза:
- липохромный гистиоцитоз;
- дефицит тубулина;
- дефицит лактоферрина;
- дефицит миозина.
❖ Лизосомальные болезни и другие нарушения обмена:
- синдром Шелье;
- синдром Санфилиппо С и D;
- маннозидоз;
- сиалидоз;
- муколипидоз III типа;
- болезнь Нимана-Пика D;
- болезнь кленового сиропа;
- галактоземия;
- синдром Баттена;
- синдром Моркио А;
- пигментная ксеродерма;
- пропионовая ацидемия;
- другие.
Показания к трансплантации определяются либо сразу после установления диагноза, либо в течение первых нескольких недель после начала лечения. Реже вопрос о трансплантации встаёт в более поздние сроки — например, после рецидива острого лимфобластного лейкоза или, что в педиатрической практике случается не так уж и редко, после рождении HLA-совместимого сиблинга.
Показания к трансплантации какого-либо заболевания определяются не только теоретической возможностью его излечения с помощью ТГСК. Не меньшее значение имеет соматический статус пациента до трансплантации, наличие органных дисфункций, латентных инфекций, а также уверенность в том, что больному будет обеспечен надлежащий уход и мониторинг не только в раннем посттрансплантационном периоде, но и в дальнейшем.
HLA-типирование и выбор донора
После принятия решения о том, что трансплантация показана, необходимо провести HLA-типирование пациента и потенциальных доноров (в первую очередь сиблингов и других родственников больного). Наиболее адекватно ДНК- типирование как по I, так и по II классу HLA-антигенов. Впрочем, для первого класса можно применять и тест комплемент-зависимой микролимфоцитотоксичности.
Учитывая, что гены HLA локализованы в пределах одной хромосомной области (сегменте МНС) и наследуются сцепленно, типирование членов одной семьи может проводиться по 6 антигенам: двум HLAA, двум HLAB и двум DRB1. Совместимым геноидентичным семейным донором считают брата или сестру реципиента, серо- логически совпадающих по всем 4 антигенам I класса и молекулярно — по двум генам DRB1, определяемым методами промежуточного или высокого разрешения. Совместимость донора и реципиента на 6/6 означает полное аллельное соответствие вышеуказанных локусов в пределах хромосомного сегмента МНС, независимо от общего количества типированных генов. Если невозможно установить происхождение аллелей донора и реципиента (например, родители имеют один общий аллель или более) или обнаружено полное совпадение с одним из родителей либо другим родственником, то такого донора называют семейным феноидентичным.
При подборе неродственного донора необходимый минимум тииируемых генов равен десяти — по паре А, В, С, DR и DQ. Согласно современным представлениям в случае совпадения по 10 антигенам из 10, донора считают совместимым и подходящим для неродственной трансплантации. В некоторых случаях совместимость на 9/10 может быть расценена как приемлемая. При острых лейкозах неродственные трансплантации от совместимых и приемлемых доноров дают результаты, идентичные таковым в случае геноидентичных трансплантаций. Результаты трансплантаций несколько хуже в случае ХМЛ и некоторых незлокачественных заболеваний. В настоящее время при наличии в 49 регистрах 37 стран около 8 миллионов потенциальных добровольных доноров вероятность нахождения донора для реципиента кавказской расы совместимого по 10 аллелям равна 68%. Поскольку в регистрах представлены данные о типировании лиц преимущественно кавказоидной расы, шансы найти совместимого донора для многих этнических групп, слабо представленных в европейских и американских регистрах, существенно ниже.
ПРЕДТРАНСПЛАНТАЦИОННОЕ ОБСЛЕДОВАНИЕ
Поскольку трансплантация — сложная процедура, чреватая тяжёлыми инфекционными и органными осложнениями, очень важно приложить все усилия для того, чтобы пациент подошёл к пересадке в наилучшем клиническом состоянии, будучи способным перенести высокодозную химиотерапию, период нейтропении, полный объём иммуносупрессивной терапии, РТПХ и т.д. Предтрансплантационное обследование реципиента окончательно подтверждает статус заболевания и приносит информацию, которая позволяет предвидеть тяжесть последствий высокодозной терапии, вероятность развития органных осложнений, связанных с иммуносупрессивной терапией, выявить латентные инфекционные очаги, генетические различия донора и реципиента для мониторинга химеризма и т.д. Ниже указаны необходимые предтрансплантационные обследования.
Потенциального донора обследуют на серологические признаки ЦМВ, ВИЧ, токсоплазмоза, гепатитов, поскольку от этих данных зависит обработка трансплантата, подход к профилактике инфекций после ТГСК и иногда сама возможность выполнения ТГСК. Необходимым требованием к донору костного мозга служит, во-первых, отсутствие противопоказаний к забору костного мозга или стволовые клетки периферической крови (СКПК), и, во-вторых, отсутствие у донора заболеваний, способных причинить вред реципиенту. При наследственных заболеваниях необходимо однозначно доказать, что донор-сиблинг здоров. В одних случаях это сделать легко — например, при талассемии или анемии Фанкони, а в других трудно, если вообще возможно — как, к примеру, при гемофагоцитарных лимфогистиоцитозах.
РЕЖИМЫ КОНДИЦИОНИРОВАНИЯ
В большинстве случаев кондиционирование преследует три цели: удаление патологических клеток, создание «ниш» для приживления трансплантата и индукцию глубокой иммуносупрессии, которая предотвращает отторжение. В качестве патологических клеток могут выступать как опухолевые популяции, так и незлокачественные, но функционально дефектные стволовые клетки - например, при талассемиях или серповидноклеточной анемии. Подходы, используемые в режимах кондиционирования, можно разделить на три группы в зависимости от их доминирующего свойства, иммуносупрессивного или противоопухолевого, хотя некоторые компоненты сочетают в себе оба эффекта.
К преимущественно миелосупрессивным препаратам со слабым иммуносупрессивным потенциалом относятся: бусульфан, цитозин-арабинозид, ингибиторы топоизомеразы II (этопозид, митоксантрон) арабинопиранозилметил нитрозомо- чевина, карбоплатин.
Для циклофосфамида характерно преобладание иммуносупрессивных свойств над миелосупрессивными/противоопухолевыми. В свою очередь антитимоцитарный глобулин, антилимфоцитарные моноклональные антитела и лимфоидное облучение оказывают исключительно иммуносупрессивное влияние.
Наконец, тотальное облучение тела, мельфалан и тиотепа сочетают сильные миело- и иммуносупрессивный эффекты.
Основа режимов кондиционирования — препараты или воздействия, миелотоксический эффект которых значительно меньше висцеральной токсичности (бусульфан, мельфалан, тотальное облучение тела). Вторым компонентом, как правило, служит иммуносупрессант (циклофосфамид, флударабин). Усиленные режимы дополнительно включают один из противоопухолевых препаратов (этопозид, тиотепа и т.д.). Суммарные дозы препаратов, включенных в режимы кондиционирования, подобраны на грани тяжёлой висцеральной токсичности.
Выбор режима кондиционирования диктуется диагнозом, стадией заболевания клиническим состоянием реципиента, наличием технической возможности
выполнения тотального облучения тела и (в случае аллогенной трансплантации) степенью совместимости донора, наличием аллосенсибилизации и необходимостью Т-деплеции трансплантата. Чем агрессивнее основное заболевание, тем больше стремление к максимальной интенсификации режимов кондиционирования.
Классические режимы кондиционирования чрезвычайно агрессивны по определению, поскольку их дозы отрабатывались для достижения максимальной эрадикации опухолевых клеток на грани жизнеугрожающей токсичности.
При аллогенной трансплантации риск рецидива наименьший, что достигается как сверхинтенсивной химиотерапией, так и аллогенным эффектом «трансплантат-против-опухоли». В то же время для алло-ТГСК характерна повышенная смертность из-за токсичности режимов кондиционирования, РТПХ и поздней инфекционной летальности. Летальность, связанная с непосредственной токсичностью режимов кондиционирования, составляет около 5% у детей и около 20% у реципиентов старше 55 лет. Кроме того, высокодозные режимы вызывают развитие поздних осложнений, значительно ухудшающих качество жизни излеченных пациентов. Всё это заставляет искать режимы кондиционирования с более низким потенциалом нежелательных последствий.
С начала 70-х годов стало известно, что для приживления донорского костного мозга при некоторых заболеваниях (АА) необходима интенсивная иммуносупрессия.
В середине 80-х годов было замечено, что лечебное действие аллогенной ТГСК напрямую коррелирует с возникновением хронической болезни РТПХ. Такой противоопухолевый эффект, присущий аллогенной трансплантации, был назван реакцией «трансплантат-против-лейкемии». Важная роль этого феномена в клиническом излечении пациентов показана при ХМЛ, острых лейкозах, ювенильном миеломоноцитарном лейкозе, множественной миеломе, миелофиброзе и хроническом лимфолейкозе. Более того, с помощью редукции иммуносупрессивной терапии и дозированных инфузий донорских лимфоцитов стало возможным в какой-то мере «управлять» эффектом «трансплантат-против-лейкемии». Из этих наблюдений стало ясно, что лечебный эффект алло-ТГСК, по крайней мере, отчасти связан с установлением иммунологического контроля над опухолью с возможностью её последующей полной эрадикации.
Другим важным открытием явилось доказательство облегчения приживления аллогенного трансплантата с помощью повышения в 5-10 раз количества трансплантируемых гемопоэтических предшественников. Этого можно достичь в результате «мобилизации» гемопоэтических предшественников с помощью Г-КСФ.
Наконец, появление в клинической практике аналогов нуклеозидов и, в частности, флударабина, который в дозах, не вызывающих практически никакой органной токсичности, способен вызывать многомесячный «паралич» функции Т-лимфоцитов, сделало возможным испытание так называемых немиелоаблативных режимов.
Классическая концепция ТГСК делает акцент на интенсивности режима кондиционирования, который опустошает костный мозг, оказывает мощное противоопухолевое действие и подавляет иммунную систему реципиента. Основная функция трансплантата в этом случае — восстановление гемопоэза.
Для миелоаблативных режимов характерно быстрое установление полного донорского химеризма. В отличие от этого, при немиелоаблативных режимах сильная иммуносупрессия, обеспечиваемая флударабином, малыми дозами тотального облучения тела, и во многих режимах, антитимоцитарным глобулином, сочетается с умеренной, полностью обратимой миелосупрессией. Задачей циторедуктивной терапии в данном случае является создание «ниш» для донорских гемопоэтических стволовых клеток. Снижение количества Т-лимфоцитов реципиента и подавление их функции обеспечивают приживление трансплантата.
Главное преимущество немиелоаблативных режимов — сниженная ранняя висцеральная токсичность, делающая возможным применение аллогенной ТГСК у пожилых пациентов, а также у всех потенциальных кандидатов на эту процедуру, клиническое состояние которых не позволяет рассчитывать на благополучный исход классической трансплантации. Вследствие малоинтенсивной химиотерапии аплазия кроветворения может не развиваться вовсе, либо быть очень короткой. Соответственно, в отношении тяжести посттрансплантационного периода и в необходимости интенсивной сопроводительной терапии (наркотические анальгетики, парентеральное питание, антибиотики и другие препараты) немиелоабла- тивные трансплантации переносятся гораздо легче. Опыт первых лет использования режимов со сниженной интенсивностью даёт основание полагать, что в случае злокачественных заболеваний проведение немиелоаблативных трансплантаций оправдано при следующих условиях:
• невозможность проведения классической миелоаблативной ТГСК (клиническое состояние или органные дисфункции, препятствующие проведению классической трансплантации, ранний рецидив после миелоаблативной трансплантации);
• медленный темп прогрессии опухоли;
• способность опухоли индуцировать аллогенный иммунный ответ.
Естественно, что при врождённых и приобретённых АА и при некоторых иммунодефицитах применяют только такие режимы.
ПРОЦЕДУРА ТРАНСПЛАНТАЦИИ
Собственно трансплантация — процедура технически несложная: трансплантат переливают пациенту внутривенно. В качестве источника стволовых клеток может использоваться костный мозг, «мобилизованные» СКПК или пуповинная кровь.
Костный мозг, забранный у донора путём множественных пункций задних верхних гребней подвздошной кости, трансплантируют в количестве 20-30 мл/кг массы тела. Клеточность трансплантата костного мозга должна превышать 3x10sклеток/кг массы реципиента.
Стволовые клетки мобилизуются в периферическую кровь с помощью ростовых факторов (при аллогенной трансплантации) или сочетанием химиотерапии и ростовых факторов (при аутологичной трансплантации) и собираются с помощью клеточных сепараторов. Качество трансплантата СКПК определяется по содержанию CD34 . Оптимальным считают введение >5х106 CD344 клеток на килограмм массы реципиента. Дозы аллогенных клеток выше 10х106 CD34J/Kr ассоциированы с повышенной смертностью после трансплантации. Приживление после трансплантации СКПК происходит значительно быстрее, чем после трансплантации костного мозга, особенно в отношении тромбоцитов.
ОТТОРЖЕНИЯ И РЕАКЦИИ «ТРАНСПЛАНТАТ-ПР0ТИВ-Х03ЯИНА»
Несмотря на сильный иммуносупрессивный эффект режима кондиционирования, резидуальные лимфоциты, пережившие мощное цитотоксическое воздействие, в некоторых случаях способны к отторжению трансплантата. С другой стороны лимфоциты, содержащиеся в трансплантате — 3-10х107/кг при пересадке костного мозга и в 10 раз больше при трансплантации СКПК, — при отсутствии профилактики вызывают у большого числа реципиентов аллогенной ТГСК смертельную РТПХ. Это обусловливает необходимость длительной иммуносупрессивной терапии после ТГСК.
ПРОФИЛАКТИКА
Наилучший метод профилактики РТПХ — удаление Т-клеток из трансплантата (Т-деплеция). Частота острой РТПХ при современных методах очистки составляет менее 5%. Вместе с тем, Т-деплеция сопровождается риском отторжения трансплантата, развития рецидивов злокачественных гемопатий, а также значительно отсроченным восстановлением клеточного иммунитета. Последнее сопряжено с повышенной вероятностью поздних смертельных вирусных и бактериальных инфекций. В связи с перечисленными фактами Т-деплецию применяют главным образом при гаплоидентичных трансплантациях. Современная профилактика отторжения и РТПХ при HLA-идентичных трансплантациях основана на применении ингибиторов кальциневрина — циклоспорина или, реже, такролимуса, к которому добавляют второй препарат — метотрексат или микофенолата мофетил. Введение циклоспорина начинается за день до инфузии стволовых клеток и продолжается в течение 3-12 мес при отсутствии РТПХ и значительно дольше при её наличии. Метотрексат вводят 3-4-кратно с 1-го по 11-й день после трансплантации с интервалом 2-4 дня.
ЭПИДЕМИОЛОГИЯ
Частота острой РТПХ у реципиентов родственных HLA-геноидентичных трансплантаций, несмотря на профилактику, составляет 30-70%. При неродственных ТГСК этот показатель может составлять 80-90%. Смертность от РТПХ и осложнений её лечения составляет 20-30%. У детей эти показатели существенно меньше, чем у взрослых.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
К необходимым условиям для развития РТПХ относят:
• наличие в трансплантате достаточного количества иммунокомпетентных клеток;
• наличие у реципиента антигенов, отсутствующих у донора и способных активировать Т-лимфоциты донора;
• неспособность самого реципиента развить иммунный ответ против трансплантата.
РТПХ рассматривают в настоящее время как иммунопатофизиологический процесс, состоящий из двух последовательных фаз: афферентной и эфферентной.
В ходе афферентной фазы ткани реципиента активируют донорские Т-лимфоциты. Активированные Т-лимфоциты пролиферируют и функционально разделяются на собственно цитотоксические эффекторы и Т-клетки, секретирующие провоспалительные цитокины.
В эфферентную фазу Т-клетки, реактивные в отношении реципиента, повреждают ткани хозяина как непосредственно, так и опосредованно через мобилизацию вторичных эффекторов: NK-клеток и макрофагов.
РТПХ, развившаяся до 100-го дня после ТГСК, считается острой, после этого срока — хронической. Однако клиническая практика, показывает, что развитие классических симптомов острой РТПХ может возникать значительно позже 100 дней, особенно при трансплантациях стволовых клеток периферической крови и попытках слишком ранней или быстрой отмены иммуносупрессивной терапии.
Известно, что риск развития у пациентов острой РТПХ различен. Неоспоримо, что главным детерминантом вероятности острой РТПХ является степень генетического различия между донором и реципиентом. Например, при трансплантациях от однояйцовых близнецов вероятность развития тяжёлой РТПХ практически нулевая, а при гаплоидентичных трансплантациях или при использовании неполностью совместимых неродственных доноров она составляет 70-90%. Повышает риск РТПХ и трансплантация от донора женского пола реципиенту мужского пола. К дополнительным факторам риска относят возраст реципиента — чем он старше, тем выше риск РТПХ.
Основные мишени острой РТПХ - кожа, ЖКТ и печень. Реже поражаются слизистые рта, конъюнктива и роговица, лёгкие, дыхательные пути, экзокринные железы.
КЛАССИФИКАЦИЯ ОСТРОЙ РЕАКЦИИ «ТРАНСПЛАНТАТ-ПРОТИВ-ХОЗЯИНА»
Широко принятая клиническая классификация острой РТПХ выделяет четыре степени поражения (gradé) каждой из трёх главных мишеней — кожи, печени и кишечника и четыре клинических стадии (stage), определяемых в зависимости от степени поражения каждого из органов и их комбинации (табл. 19-3,19-4).
Таблица 19-3. Классификация острой реакции «трансплантат-против-хозяина» по степени органного поражения
|
Степень (grade) |
1 |
II |
III |
IV |
|
Кожа |
Сыпь <25% поверхности тела |
Сыпь 25-50% поверхности тела |
Генерализованная эритродерма |
Буллёзный эпидермолиз |
|
Диарея, мл/сут |
||||
|
Кишечник |
500-1000 Изолированная тошнота и рвота |
1000-1500 |
>1500 |
Сильная боль Илеус |
|
Билирубин, Цмоль/л |
||||
|
Печень |
34-51 |
51-102 |
102-255 |
>255 |
Таблица 19-4. Классификация острой реакции «трансплантат-против-хозяина» по клиническим стадиям
|
Стадия |
0 |
1 |
II |
III |
IV |
|
(stage) |
нет |
лёгкая |
умеренная |
тяжёлая |
жизнеугрожающая |
|
Кожа |
0 |
I-II |
I-III |
I-III |
II-IV |
|
Кишечник |
0 |
0 |
I |
II-III |
II-IV |
|
Печень |
0 |
0 |
I |
II-III |
II-IV |
КЛИНИЧЕСКАЯ КАРТИНА
К самым типичным и ранним симптомам кожной РТПХ относят покраснение кожи. В разные сроки, чаще через 5-7 дней после образования эритемы, появляется красная пятнисто-папулёзная сыпь, которая может быть локализована повсюду, в том числе на ладонях и стопах, и имеет тенденцию к слиянию. Изредка возникает буллёзное поражение кожи с отслоением эпидермиса, и пациент приобретает вид «ожогового» больного. Дальнейшие волны кожной РТПХ не всегда протекают на фоне сильной эритемы, и инфильтративный компонент может быть выражен в меньшей степени.
При кишечной РТПХ поражение локализовано преимущественно в тонкой и толстой кишке. Самое типичное проявление кишечной РТПХ — диарея. По времени диарейный синдром либо совпадает с кожными проявлениями РТПХ, либо следует вскоре за ними. В дебюте кишечной РТПХ стул обычно жидкий, богатый белком, без патологических примесей, зелёного цвета. Иногда стул сохраняется полуоформленным и обращает на себя внимание лишь его учащение до 5-8 раз в сутки. При прогрессировании кишечной РТПХ стул приобретает водянистый характер, иногда его объём доходит до нескольких литров в сутки с развитием обезвоживания и тяжёлых электролитных нарушений. Зачастую из-за существенной потери белка вследствие экссудации через кишечную стенку развивается гипоальбуминемия. В случае неэффективности лечения в стуле появляется примесь крови,
которая, в зависимости от локализации преимущественного поражения и скорости кишечного транзита, может быть тёмно-красной, ярко-красной или чёрной. Поскольку РТПХ может поражать любой отдел ЖКТ, помимо примеси крови в стуле может наблюдаться и рвота с кровью. Боль не характерна для дебюта и ранней фазы кишечной РТПХ, однако появление выраженной гематомезии зачастую совпадает с развитием кишечного болевого синдрома.
Особой формой РТПХ, пока не входящей в общепринятые классификации, является изолированная пищеводно-желудочная РТПХ. При этой форме клиническая картина состоит из тяжёлой анорексии, мучительной тошноты и рвоты без каких-либо нарушений стула.
Необходимо различать острую кишечную РТПХ и инфекционные поражения толстой и тонкой кишки — нейтропенический энтероколит, псевдомембранозный колит и ЦМВ-колит, ротавирусный гастроэнтерит и т.д. Необходимо отметить, что РТПХ способна развиваться на фоне инфекций или непосредственно запускаться вследствие инфекционного поражения кишечника, что может затруднить постановку точного и своевременного диагноза.
В пегени основным объектом поражения при острой РТПХ является эпителий жёлчных капилляров, поэтому главное клиническое проявление РТПХ — желтуха и соответствующее ей увеличение концентрации билирубина в сыворотке крови. Последнее касается преимущественно прямой фракции билирубина. Вместе с тем, в случае значительного увеличения содержания прямого биллирубина абсолютные значения непрямой фракции также могут быть существенно повышены. Типичное, хотя и неспецифичное проявление печёночной РТПХ — умеренный рост активности сывороточной щёлочной фосфатазы, сопутствующий повышению концентрации билирубина. Активность «печёночных» ферментов в крови традиционно не принимают в расчёт как критерий поражения печени при РТПХ, однако иногда повышение активности АЛТ и ACT служат единственным проявлением данной формы РТПХ.
ЛЕЧЕНИЕ
Несмотря на прогресс в понимании патофизиологии острой РТПХ основным средством её лечения в течение более 30 лет остаётся системное применение ГК. В качестве стартовой терапии РТПХ пациенту назначают метилпреднизолон в дозе 2 мг/кг внутривенно. Полным ответом на ГК считают абсолютное исчезновение старых и отсутствие новых проявлений РТПХ. Сохранение той же клинической стадии РТПХ или степени органного поражения расценивают как отсутствие ответа (рефрактерностъ). Если на фоне лечения ГК клиническая стадия или степень органного поражения нарастают, то говорят о прогрессии. Снижение клинической стадии РТПХ на одну и более при неполном её разрешении считают частичным ответом на ГК. Деление на неполный эффект и рефрактерность достаточно условно, поскольку не до конца разрешившаяся РТПХ в прогностическом отношении ненамного лучше, чем рефрактерная и может точно также требовать альтернативного лечения. О рецидиве острой РТПХ говорят в случае возникновения её симптомов повторно после полного разрешения на фоне проводимого лечения. Международным консенсусом закреплены следующие критерии рефрактерности/ резистентности к ГК:
• прогрессия в течение трёх дней от начала лечения метилпреднизолоном в дозе 2 мг/кг;
• отсутствие положительной динамики в течение 7 дней лечения метилпреднизолоном по 2 мг/кг;
• неполный ответ в течение 14 дней лечения метилпреднизолоном по 2 мг/кг.
Вероятность полного и окончательного разрешения первой волны РТПХ с помощью инициальной терапии ГК составляет 40-60%, у остальных больных
РТПХ либо рецидивирует на каком-либо из этапов снижения доз ГК, либо оказывается резистентной к ним.
При резистентности РТПХ к ГК применяют препараты 2-й линии — АТГ иммуноглобулин антитимоцитарный (АТГ-Фрезениус С, тимоглобулин, антилимфолин и пр.), микофенолата мофетил, реже — моноклональные антитела к различным антигенам лимфоцитов — анти-СD3 муромонаб-СD3 и даклизумаб. Прогноз при рефрактерной к ГК РТПХ плохой — выживает не более 30% пациентов.
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА ИНФЕКЦИЙ У РЕЦИПИЕНТОВ
Интенсивная миело- и иммуноаблативная терапия, применяемая для подготовки реципиента к трансплантации, РТПХ и интенсивная медикаментозная иммуносупрессия повреждают практически все естественные факторы антимикробной защиты: физическую целостность кожи и слизистых, функцию и количество нейтрофилов и макрофагов, функцию Т- и В-лимфоцитов, опсонизирующую функцию селезёнки и другие. Вследствие этого больные подвержены широкому спектру оппортунистических инфекций. По существу реципиенты ТГСК страдают от тяжёлого комбинированного иммунодефицита. Риск развития тех или иных инфекций распределён неравномерно в течение посттрансплантационного периода и зависит от скорости восстановления уровня нейтрофилов, развития РТПХ и успешности её лечения (рис. 19-1).
Существует несколько постулатов, определяющих принципы лечения инфекций у реципиентов ТГСК.
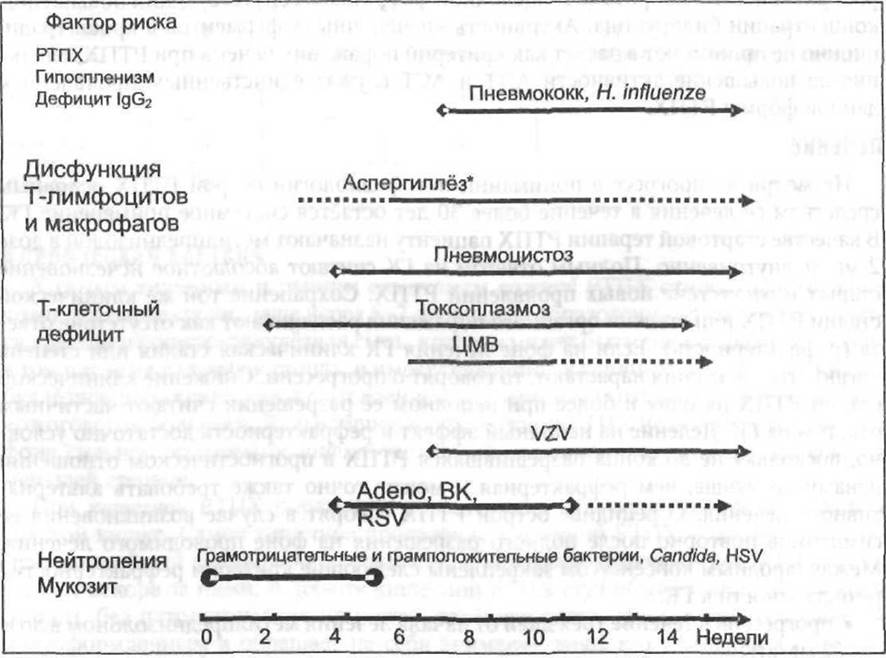
Рис. 19-1. Факторы риска и сроки развития инфекций после аллогенной трансплантации гемопоэтических стволовых клеток. * К предрасполагающим факторам развития инвазивного аспергиллёза также относятся предшествующая бронхолёгочная колонизация и дисфункция ресничек бронхиального эпителия.
• Все инфекции, возникающие у скомпрометированных иммунологически больных, потенциально смертельны и имеют склонность к фульминантному течению.
• Возникновение любой, даже самой тяжёлой, инфекции после ТГСК может иметь скудные локальные клинические симптомы и маскироваться признаками токсичности высокодозной химиотерапии. Самое типичное проявление инфекции — лихорадка неясного генеза.
• Эмпирическое лечение инфекции должно быть начато немедленно по возникновении подозрения на неё. Коррекцию терапии проводят в соответствии с клиническим и, при доступности соответствующих данных, микробиологическим ответом.
• Очень важно установить точный этиологический диагноз. В связи с этим максимум диагностических мероприятий должен быть выполнен в кратчайшие сроки.
• Критическим является восстановление нарушенных факторов защиты.
Медикаментозное предупреждение бактериальных инфекций после ТГСК — чрезвычайно сложная задача, единых подходов к которой нет. Мнения о целесообразности проведения так называемой селективной деконтаминации значительно разнятся, хотя в большинстве центров все же прибегают к профилактическому применению фторхинолонов в перитрансплантационный период.
В отличие от антибактериальной профилактики необходимость предупреждения грибковых инфекций очевидна. Практически все реципиенты ТГСК в настоящее время получают длительную профилактику флуконазолом, применение которого улучшает выживаемость после алло-ТГСК. Необходимая длительность приёма флуконазола неизвестна, однако показано, что его продлённое применение увеличивает выживаемость больных. Если у больного до трансплантации был инвазивный лёгочный аспергиллёз, то назначают вориконазол на весь период нейтропении и лечения ГК. Помимо противогрибковой и антибактериальной профилактики все реципиенты ТГСК должны получать профилактику пневмоцистной пневмонии триметоприм/сульфаметоксазолом в дозе 20-30 мг/кг в сутки по сульфаметоксазолу 3 дня в неделю до трансплантации и начиная с 21-го дня после неё вплоть до окончания посттрансплантационной иммуносупрессии. Эффективность такой профилактики приближается к 100%.
Профилактика вирусных инфекций чаще всего сводится к внутривенному назначению ацикловира в дозе 250 мг/м2 3 раза в сутки начиная со дня (-7) и заканчивая днём, когда препарат можно принимать через рот. Далее приём ацикловира (или валацикловира) внутрь продолжается минимум до срока 180 дней после трансплантации. Профилактическое применение ганцикловира или фоскарнета способно предотвратить раннюю реактивацию ЦМВ и ранние ЦМВ-ассоциированные синдромы, поэтому в некоторых центрах эти препараты применяют для лечения больных высокого риска (например, серопозитивных реципиентов Т-деплетированного костного мозга). Однако потенциальная миело-токсичность первого средства и нефротоксичность второго ограничивают их применение. Не менее серьёзную опасность представляет увеличение частоты поздних ЦМВ-пневмоний в связи с замедлением становления анти-ЦМВ иммунитета.
Несмотря на многоплановые и дорогие профилактические мероприятия, инфекции остаются серьёзной проблемой раннего посттрансплантационного периода. Поражение слизистых и абсолютный агранулоцитоз предрасполагают к развитию фульминантных бактериемий, которые в группе реципиентов ТГСК встречаются гораздо чаще, чем в других группах пациентов.
К типичным возбудителям, высеваемым из крови реципиентов ТГСК, относят коагулазоотрицательные стафилококки, зеленящие стрептококки, грамотрицательные бактерии (Е. coli, К. pneumoniae, Ps. aeruginosa) и грибы рода Candida.
Первый же эпизод лихорадки у больного после ТГСК служит показанием к немедленному началу агрессивной эмпирической антибактериальной терапии.
Выбор первоначального алгоритма лечения зависит от тяжести состояния больного, проводимых профилактических мероприятий, проявления признаков септического шока, клинической нестабильности и каких-либо локальных симптомов. Кроме того, интенсивность режима кондиционирования и наличие поражений полости рта и ЖКТ также влияют на выбор стартовой терапии. Базовыми препаратами инициального режима являются бета-лактамы широкого спектра с антисинегнойной активностью (цефепим, пиперациллин/тазобактам, меропенем, цефтазидим). В зависимости от клинической картины бета-лактам комбинируют с амикацином и/или ванкомицином.
Время ожидания до постановки вопроса о коррекции алгоритма лечения составляет 72 ч в случае отсутствия ухудшения состояния пациента. При сохранении лихорадки в течение этого периода, обычно производят смену бета-лактама и назначение эмпирической антимикотической терапии. Оптимальным препаратом для противогрибкового лечения у реципиентов аллогенной ТГСК, которым необходимо совместное применение противогрибковых препаратов и нефротоксично- го циклоспорина, является каспофунгин. В случае аутологичной трансплантации в качестве препарата выбора по-прежнему используют амфотерицин В вследствие его дешевизны (рис. 19-2).
Как правило, больные выписываются из отделения трансплантации в течение 5- 7-й недели после ТГСК. В этот период особую опасность для больных, попавших из стерильного окружения в нестерильное, представляют плесневые грибы, респираторные вирусы и капсулообразующие бактерии. При развитии умеренной и тяжёлой РТПХ необходима комбинированная иммуносупрессивная терапия, поэтому большинство серьёзных инфекций, наблюдаемых в этой фазе, возникают именно у пациентов с РТПХ. Все инфекции, особенно сопровождаемые признаками системного воспалительного ответа, должны лечиться современными антибиотиками широкого спектра, активными в отношении пневмококка, гемофилюса, клебсиеллы и синегнойной палочки, с последующей коррекцией в зависимости от ответа.
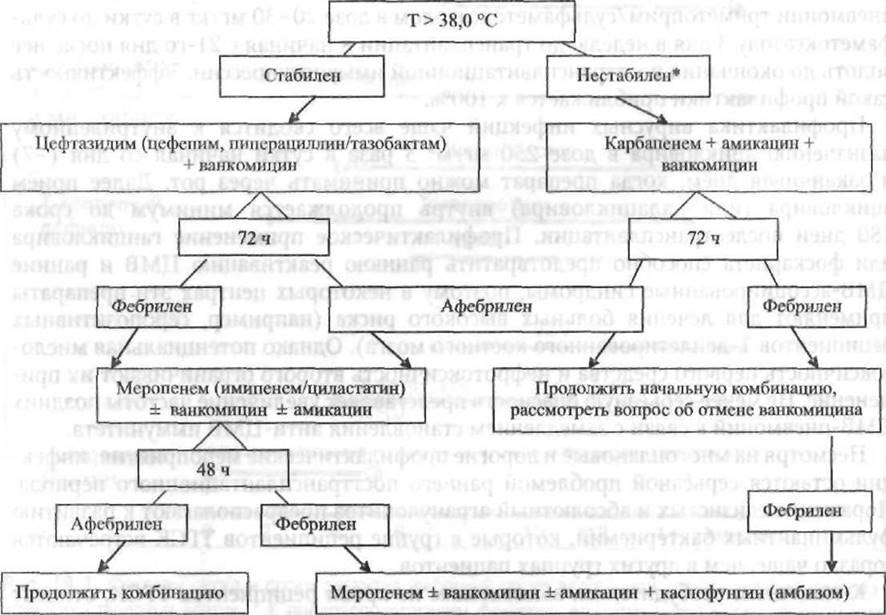
Рис. 19-2. Алгоритм эмпирической антимикробной терапии при лихорадке неясной этиологии у реципиентов трансплантации гемопоэтических стволовых клеток. * Нестабильность: артериальная гипотензия, нарушения сознания, ознобы, тяжёлый мукозит, признаки фокальной инфекции.
Излюбленной локализацией инфекций в промежуточном посттрансплантационном периоде являются лёгкие, что связано с поражением функции ресничек респираторного тракта, реактивацией эндогенных вирусов и контактом с банальными инфекционными агентами. Если лёгочная инфекция имеет очаговый характер, то её этиология чаще всего бактериальная или грибковая. В связи с этим инициальная терапия обычно состоит из антибиотиков широкого спектра. Однако зачастую в этой стадии лёгочное поражение имеет диффузный интерстициальный характер вирусной природы. Среди этиологических агентов доминирует ЦМВ, значительно реже выделяют аденовирус, респираторно-синтициальный вирус, вирусы парагриппа и гриппа. Если инфекционный агент не обнаружен, то такие случаи относят к «идиопатическим» интерстициальным пневмонитам. Ранее ЦМВ-пневмонию относили к доминирующим факторам смертности в промежуточную посттрансплантационную фазу. До 15-20% всей посттрансплантационной летальности было или непосредственно обусловлено ЦМВ-пневмонией, или тесно связано с ней. В настоящее время и частота ЦМВ-пневмонии, и смертность от этого осложнения значительно снизились. У детей риск ЦМВ-пневмонии в целом существенно ниже, чем у взрослых. Наилучшей мерой контроля ЦМВ-инфекции на сегодняшний день считают мониторинг виремии и упреждение заболевания. Выявление виремии в доклинической фазе позволяет начать эффективное лечение ганцикловиром и предупредить развития тяжёлых висцеральных поражений. Симптомы развившейся ЦМВ — одышка, сухой кашель, лихорадка и прогрессирующая гипоксемия. Рентгенологическая картина — интерстициальное поражение, не имеющее существенных отличий от других интерстициальных пневмоний. Диагноз ЦМВ-пневмонии подтверждают обнаружением либо характерных включений ЦМВ в клетках, полученных из лёгких при бронхо-альвеолярном лаваже, либо цито- мегаловирусной ДНК в лаважной жидкости больного. Лечение ЦМВ-пневмонии очень затруднительно, наилучший на сегодня метод — ганцикловир и высокие дозы иммуноглобулина антицитомегаловирусный (1 г/кг через день 3 раза, далее по 500 мг/кг 1 раз в неделю) позволяют вылечить только 50% больных.
Другой частой причиной интерстициальной пневмонии с высокой летальностью в прошлом была Pneumocystis carinii. Профилактическое применение триметопри- ма/сульфаметоксазола против данного возбудителя в высшей степени эффективно. Практически все случаи развития пневмоцистоза связаны с перерывом в профилактике длительностью более двух недель. В лечении развившейся пневмонии препаратом выбора служит триметоприм/сульфаметоксазол внутривенно в дозе 75-100 мг/кг по сульфаметоксазолу на 21 день. Для улучшения диффузии кислорода очень важно предотвратить задержку жидкости, кроме того, возможно, что назначение ГК уменьшает интерстициальный воспалительный компонент и улучшает оксигенацию.
Инфекционное интерстициальное лёгочное поражение может быть вызвано и внутриклеточными микроорганизмами — микобактериями, легионеллой, микоплазмой и хламидией, профилактику которых обычно не проводят после ТГСК. Установить этиологический диагноз в таких случаях можно только при исследовании лаважной жидкости микробиологическими и молекулярно-биологическими методами.
Другие инфекционные поражения, часто возникающие в промежуточный посттрансплантационный период, включают синуситы (бактериальной или грибковой этиологии), кожные инфекции или катетерный сепсис.
Пациенты, достигшие поздней посттрансплантационной фазы (после сотого дня) без экстенсивной хронической РТПХ, сравнительно редко страдают от серьёзных инфекций. Пациенты же, получающие иммуносупрессивное лечение РТПХ, остаются подвержены высокому риску тяжёлых инфекций, в основном бактериальной и грибковой этиологии.
Из вирусных инфекций на этом этапе чаще возникает реактивация вируса Varicella zoster. Профилактика ацикловиром снижает частоту реактивации Varicella zoster до 180-го дня, однако в более поздних стадиях его влияние не отличается от эффекта плацебо. Несмотря на то, что zoster-инфекция зачастую ограничена одним или несколькими дерматомами, она может диссеминировать и вызвать тяжёлые висцеральные поражения (гепатиты, пневмонии, энцефалиты). Во всех случаях zoster-инфекции в первые 7 дней рекомендуют применять ацикловир внутривенно (500 мг/м2 каждые 8 ч), и только если инфекция остаётся ограниченной дерматомами можно перейти на пероральное назначение ацикловира (500 мг/м2 5 раз в день) или валацикловира (1000 мг/м2 3 раза в день).
РЕЦИПИЕНТЫ АУТОЛОГИЧНЫХ ТРАНСПЛАНТАЦИЙ
Подходы к профилактике и лечению инфекций в перитрансплантационную фазу совпадают у реципиентов аллогенных и аутологичных трансплантаций, поскольку иммуносупрессивный и миелоаблативный потенциал режимов кондиционирования идентичен. Однако отсутствие посттрансплантационной иммуносупрессии существенно снижает инфекционные риски после выхода из агранулоцитоза. В связи с этим после восстановления числа гранулоцитов профилактическое назначение флуконазола не рекомендовано. Профилактику пневмоцистоза и реактивации HSV и Varicella zoster проводят ацикловиром (зовираксом*) до дня (+90), если основное заболевание (например, болезнь Ходжкина) не требует более длительного приёма препарата. Профилактика пневмококковой и гемофилюсной инфекции не отличается от таковой у реципиентов алло-ТГСК, хотя функция селезёнки может страдать меньше, чем при аллогенных трансплантациях.
РЕЗУЛЬТАТЫ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
Причинами смерти после ТГСК служат токсичность режимов кондиционирования, РТПХ, инфекции, а также рецидивы заболевания. Все эти факторы взаимосвязаны: при продвинутых стадиях злокачественных гемопатий выше риск и токсичности, и РТПХ, и рецидивов. Ниже приведены результаты, достижимые с помощью ТГСК (табл. 19-5).
Таблица 19-5. Основные результаты трансплантации гемопоэтических стволовых клеток
|
Нозология |
Выживаемость, % |
|
|
алло-ТГСК |
ауто-ТГСК |
|
|
ОЛЛ |
30-60 |
- |
|
ОМЛ |
30-70 |
40-50 |
|
ХМЛ |
ХФ 50-90 ФАЗО БК 5-10 |
— |
|
Лимфомы |
- |
50-70 |
|
Апластические анемии |
80-90 |
- |
|
Иммунодефициты |
50-75 |
- |
|
Гемоглобинолатии |
50-80 |
- |
|
Солидные опухоли |
- |
20-30 |