Евгения П. Сеппа, Аврора Д. Приор
Протрузия дна желудка в средостение кпереди от пищеводно-желудочного перехода известна как параэзофагеальная грыжа (ПЭГ). ПЭГ составляет только 5% всех грыж пищеводного отверстия диафрагмы, но предвещает плохой прогноз при экстренном лечении. Наиболее серьезным, угрожающим жизни осложнением ПЭГ являются заворот или ущемление желудка. Однако плановая лапароскопическая пластика после своевременной диагностики безопасна и дает хорошие результаты.
Первое описание ПЭГ датируется намного позже, чем описание травматической диафрагмальной грыжи Ambrose Раге в 1579 г. Вероятнее всего, техники аутопсии, применяемые до наступления XX в., делали невозможным распознавание ПЭГ. В 1800-х гг. Rene Laennec и Astley Cooper независимо друг от друга предположили, что органы брюшной полости могут выпячиваться в грудную полость через естественные отверстия в диафрагме. Henry Bodwitch сообщил о первом известном случае ПЭГ во время посмертного исследования. В его описании пищевод опустился через диафрагму и вернулся с левой стороны через апертуру в грудную полость, где соединился с желудком [1].
В начале XX в. ПЭГ была признана самостоятельной нозологической единицей, это стало возможным в первую очередь с использованием рентгенографии в дополнение к истории заболевания и физикальному осмотру. Несколько врачей обобщили свой клинический опыт по диафрагмальным грыжам, выходящим через пищеводное отверстие, что привело к описанию анатомической проблемы, связанных с ней симптомов и в итоге к появлению классификации. Радиолог Мах Ritvo [2] после обзора проведенных им исследований пищевода с барием описал патофизиологию ПЭГ. Он предположил, что данные грыжи возникают из-за повышения внутрибрюшного давления. Moore и Karklin [3] описали важность лежачей позы и ручного давления на живот во время исследований пищевода с барием при диагностике ПЭГ.
ХИРУРГИЧЕСКАЯ АНАТОМИЯ
Эмбриологически диафрагма происходит из эмбриональной anterior septum transversum, тканей заднего ребродиафрагмального отростка (7-12-я сегментарные миотомы) и латеральных плевроперитонеальных складок. Таким образом, у взрослых диафрагма прикреплена к мечевидному отростку, нижним шести реберным хрящам и медиальной и латеральной пояснично-реберной дуге (рис. 7-1). Правая ножка отходит от Lj-Tjjj, а левая — от Lj—Lu. Мышцы переходят в центральную сухожильную часть. Они получают соматическую моторную иннервацию от диафрагмального нерва (С3-С5), который входит в диафрагму латеральнеє отверстия нижней полой вены (НПВ) и левого края сердца справа и слева соответственно. Кровь диафрагма получает из мышечно-диафрагмальной, перикардиодиафрагмальной, верхней диафрагмальной и нижней диафрагмальной артерий. Эти сосуды исходят из надчревного отдела аорты и чревного ствола.

Рис. 7-1. Анатомия диафрагмы.

Рис. 7-2. Классификация грыж хиатуса. Нормальная анатомия (А). Параэзофагеальная грыжа 1-го типа (ПЭГ) — скользящая грыжа хиатуса — наиболее часто встречаемая форма (95%), характеризуется миграцией пищеводно-желудочного перехода и лежащей рядом кардии выше диафрагмы, в средостение, через пищеводное отверстие (Б). ПЭГ 2-го типа встречаются реже, чем ПЭГ 1-го типа, но считаются истинными ПЭГ. Для них характерна солитарная миграция кардии желудка через пищеводное отверстие в грудную клетку кпереди от нормально расположенного пищеводно-желудочного перехода (В). ПЭГ 3-го типа — это комбинация грыж 1 -го и 2-го типа, при которой пищеводно-желудочный переход с прилежащим участком желудка и кардией выпячивается через пищеводное отверстие (Г). Эти грыжи могут быть крупными, с выпячиванием в средостение более 50% всего желудка и картиной вывернутого в грудную полость желудка, связанного с брюшной полостью только привратником. ПЭГ 4-го типа является самой редкой формой ПЭГ, сходна с грыжами 3-го типа, но в грыжевом мешке находятся также другие органы брюшной полости (ободочная кишка, поджелудочная железа, участок тонкого кишечника или селезенка) (Д).
Внутренние грудные артерии и ветви грудной аорты кровоснабжают верхнюю часть диафрагмы. Правая диафрагмальная вена впадает в нижнюю полую вену, а левая диафрагмальная вена — в нижнюю полую вену или левую надпочечниковую/почечную вену.
В диафрагме имеется три отверстия. Отверстие нижней полой вены находится в центральном сухожилии на уровне Т . Через него проходит НПВ и правый диафрагмальный нерв. Пищеводное отверстие расположено в мышечной порции диафрагмы и расщепляет ее правую ножку на уровне Т , пропуская пищевод и оба (задний и передний) ствола блуждающего нерва. Аортальное отверстие находится за правой и левой ножками диафрагмы на уровне Т , через него проходят аорта, непарная вена, большой внутренностный нерв и грудной лимфатический проток. Также в диафрагме существуют несколько менее известные пространства, служащие потенциальными источниками грыжеобразования. Это центральное сухожилие (перитонеокардиальная грыжа), отверстия Можанди и Бохдалека. Различают 4 типа параэзофагеальных грыж.
• Тип 1 ПЭГ — скользящая грыжа пищеводного отверстия, наиболее часто встечаемая форма (95%), характеризуется миграцией желудочно-кишечного перехода и кардии желудка выше диафрагмы через пищеводное отверстие в средостение (рис. 7-2, Б) [4].
• ПЭГ 2-го типа не так распространена, как тип 1, но считается истинной ПЭГ. Она представляет собой солитарную миграцию кардии желудка через пищеводное отверстие в грудную клетку кпереди от нормально расположенного ЖПС (рис. 7-2, В).
• ПЭГ 3-го типа — комбинация ПЭГ типов 1 и 2, при которой ЖПС с прилежащей частью желудка плюс (в дополнение к этому) кардия желудка выпячиваются через пищеводное отверстие (рис. 7-2, Г). Эти грыжи могут быть крупными, содержать более чем 50% желудка в средостении, и вывернутый в средостение желудок остается связанным с брюшной полостью только привратником.
• Тип 4 — самая редкая форма ПЭГ, схож с типом 3, но содержимым грыжи при этом является другой орган брюшной полости (ободочная кишка, поджелудочная железа, участок тонкой кишки или селезенка) (рис. 7-2, Д)1.
1 В нашей стране применяется иная классификация грыж пищеводного отверстия диафрагмы. — Примеч. ред.
ОБСУЖДЕНИЕ ОПЕРАТИВНЫХ МЕТОДИК
Лапароскопическая пластика ПЭГ, рассмотренная в подробностях на рис. 7-3—7-14, является приемлемой хирургической техникой в лечении грыж пищеводного отверстия диафрагмы. Тем не менее в теме пластики ПЭГ есть несколько дискуссионных вопросов. Клинические симптомы, обследование и показания к операции у большинства хирургов не вызывают разногласий. Однако детали операции остаются предметом постоянных дебатов и точкой приложения научного поиска. Важнейшие вопросы дискуссии — доступ (открытый или лапароскопический), частота рецидивов, добавление антирефлюксной операции и усиление ножек диафрагмы с помощью протезов.
ПЭГ проявляются классическими симптомами гастроэзофагеального рефлюкса, такими как дисфагия, изжога и регургитация. Часто встречаются рвота, боли в эпигастральной области живота и под грудиной, реже отмечаются астма и пневмония. При диагностике с помощью рентгенографии грудной клетки в боковой проекции можно установить ретрокардиальную полноту, уровень жидкости и воздуха ретрокардиально или воздушный пузырь желудка, находящийся выше диафрагмы. Кроме того, для определения размера дефекта хиатуса можно использовать ФЭГДС. КТ брюшной полости может выявить в грыжевом мешке другие органы брюшной полости. Однако «золотым стандартом» диагностики считается исследование с барием. Другой важный клинический сценарий, о котором следует помнить, — ущемление желудка или кишечная непроходимость. При этом отмечают дисфагию, периодическую рвоту и боли в грудной клетке. Такое состояние требует немедленной эндоскопической оценки и, возможно, хирургического вмешательства.
Показания к операции при разных типах ПЭГ различаются. Показанием к операции при грыжах 1 типа служит постоянство симптоматики, требующее медикаментозной терапии, а также непереносимость лекарственной терапии или любые осложнения гастродуоденальной рефлюксной болезни (пищевод Барретта, кровотечение, стриктура, перфорация или образование язвы). Грыжи 2-4-го типа лучше оперировать в плановом порядке после постановки диагноза из-за высокого количества осложнений (29%) от медикаментозной терапии и высокой смертности (50%) после экстренного оперативного вмешательства [5].
Основные этапы пластики — это низведение желудка в брюшную полость, иссечение грыжевого мешка в средостении, сшивание ножек диафрагмы и фундопликация. Активное обсуждение возникает вокруг выбора доступа (открытого или лапароскопического) [6-8]. Ferri et al. [9] установили, что для лапароскопической пластики ПЭГ характерны значительно более низкое количество интраоперационных осложнений и меньшая кровопотеря. Также в сравнении с открытой пластикой ПЭГ снижено время до начала самостоятельного питания, продолжительность пребывания в клинике и потребность в наркотических средствах. Между тем в исследуемых группах не было различий в количестве анатомических рецидивов, качестве жизни и удовлетворенности пациентов. В свете множества проведенных исследований, сравнивающих лапароскопический и открытый доступы, большинство авторов признали, что лапароскопическая пластика ПЭГ сопровождается более безопасными исходами операции и меньшей частотой послеоперационных осложнений.
Рецидив ПЭГ — нежелательный результат, однако имеется мало различий в количестве рецидивов в зависимости от того, был ли применен лапароскопический или открытый доступ. Многие ретроспективные исследования описывали частоту возникновения рецидивов, но трудность состоит в том, что ни одно из них не предлагает четкого опредения понятия «рецидив». Некоторые авторы понимают под рецидивом возвращение симптомов, а другие описывают его на основе данных послеоперационной рентгенографии с барием независимо от симптоматики. Такое явное несоответствие делает трудным выявление различий между исследованиями. Вопрос, является ли бессимптомный рецидив клинически значимым, остается открытым. Тем не менее метаанализ 32 коллективных ретроспективных исследований, проведенный Draaisma et al. [10], выявил средний уровень рецидивов 9,1% после открытых операций и 7% — в группе лапароскопии. Эти данные наводят на мысль, что лапароскопическая пластика имеет небольшое преимущество над открытой по частоте рецидивирования.
Применение антирефлюксных методик при ПЭГ в настоящее время является общепризнанной практикой. Это связано, в частности, со значительной частотой возникновения симптомов гастроэзофагеального рефлюкса, если вмешательство не сопровождалось фундопликацией. Также улучшение техники и большой объем антирефлюксных операций, проведенных хирургом, приводят к лучшей редукции симптомов заболевания. Несколько авторов поддерживают необходимость проведения антирефлюксных процедур и полагают, что предотвращение послеоперационного рефлюкса с помощью фундопликации несет минимальный дополнительный хирургический риск [11]. Draaisma et al. [10] правильно акцентировали внимание на том, что не было проведено проспективных исследований, связывающих использование антирефлюксных процедур и профилактику рецидивирования ПЭГ. Фундопликацию проводят в первую очередь для того, чтобы предотвратить симптомы гастроэзофагеального рефлюкса после операции, а не в качестве профилактики рентгенологических рецидивов.
Одним из основных спорных вопросов остается длина пищевода при пластике ПЭГ. Общепринятым считается, что гастроэзофагеальный переход при адекватной пластике должен располагаться интраабдоминально. Этого обычно можно достичь с помощью адекватной мобилизации внутригрудного отдела пищевода, часто вплоть до уровня непарной вены. Однако в некоторых случаях возникает необходимость в процедурах, удлиняющих пищевод. В условиях лапароскопической операции этого можно достичь с помощью модифицированной гастропластики Коллиса с краевой резекцией угла Гиса и внутригрудного отдела пищевода. Лапароскопический вариант операции Коллиса проводят с помощью бужа. Применение этой методики сопровождается хорошими результатами (рис. 7-5) [12].
Усиление ножек с помощью протезов приводит к снижению частоты рецидивов заболевания и минимуму осложнений. Имплантация синтетической сетки в области грыжевого дефекта может сопровождаться послеоперационной дисфагией, разрывом сетки, образованием стриктур и язв [13]. Во многих исследованиях ретроспективно сравнивали частоту рецидивирования после обычных и лапароскопических пластик с применением сетки, но проспективных рандомизированных исследований было проведено мало. Одно из них оценивало усиление ножек после пластики ПЭГ с помощью политетрафторэтиленовой сетки [14]. Авторы обнаружили значительное снижение частоты развития рецидивов в связи с применением сетки (0%) в сравнении с простой пластикой (20%) при среднем сроке наблюдения 40 мес. Granderath et al. [13] рандомизировали 100 пациентов для пластики пищеводного отверстия диафрагмы полипропиленовой заплаткой против обычной пластики хиатуса во время лапароскопической фундопликации по Ниссену. Через 1 год после обычной пластики зафиксировано 26% случаев рецидивов, а после пластики сеткой — 8%. Различий в частоте возникновения симптомов гастроэзофагеального рефлюкса после операции между двумя группами не было, в то время как пластика сеткой сопровождалась в 3 раза большей частотой послеоперационной дисфагии. Недавно в мультицентровом проспективном рандомизированном исследовании было изучено применение биологических протезов (SIS, ацелюллярного ксенолоскута на основе свиного коллагена 1-го типа) [15]. Авторы установили, что пластика с биологическим материалом значительно снижает частоту развития рецидивов в сравнении с обычной пластикой. Частота осложнений была сходной в обеих группах. Считается, что преимущество биологических протезов — минимизация риска разрыва сетки и развитие дисфагии в связи с мягкостью материала и интеграцией протеза в ткани тела. Таким образом, применение сеток в лапароскопической пластике ПЭГ безопасно и снижает уровень рецидивирования.
Гастростомия была предложена в качестве необходимого дополнения к пластике ПЭГ в «эру» открытой хирургии [16]. Она была модифицирована в переднюю гастропексию и редко применяется при современных лапароскопических пластиках. Вопрос о необходимости гастростомии или гастропексии остается спорным, хотя гастропексия незначительно повышает частоту послеоперационных осложнений [17].
Лапароскопическая пластика ПЭГ является безопасным и эффективным хирургическим вмешательством. Лапароскопическая операция сравнима с открытой по уровню послеоперационных осложнений, но имеет более низкий уровень интраоперационных осложнений, меньшие частоту развития рецидивов и продолжительность госпитализации. Использование пластики сеткой и фундопликации желудка при лапароскопическом доступе дает дополнительное снижение числа рецидивов и послеоперационных симптомов. Таким образом, лапароскопическая пластика ПЭГ является методикой выбора в лечении этой патологии.
ПОДГОТОВКА

Рис. 7-3. Обстановка операционной для лапароскопической пластики диафрагмальной грыжи. Расположение оборудования и персонала идентичны таковым при лапароскопической фундопликации по Ниссену. Авторы предпочитают укладывать пациента на спину для облегчения подготовки к операции и в связи с отличной визуализацией и удобным задним доступом.
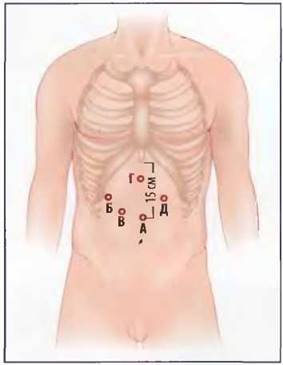
Рис. 7-4. Места расположения портов с размерами. Обычно используют пять троакаров. Порт для камеры устанавливают на 15 см ниже мечевидного отростка по средней линии (А). 5- (Б) и 11-миллиметровый троакар (В) располагают для хирурга в правом верхнем квадранте. Пятимиллиметровый порт (Г) в подмечевидной области используют для ретракции печени, а 5-миллиметровый порт (Д) в левом верхнем квадранте — для ассистента.
ОПЕРАЦИЯ
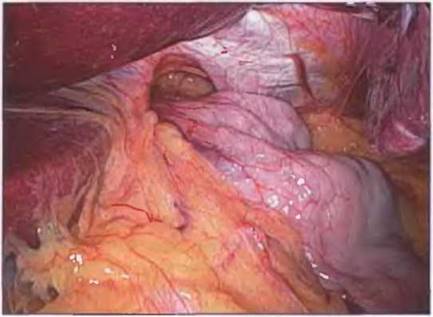
Рис. 7-5. Первый шаг операции — вправление грыжевого содержимого. На снимке представлен параэзофагеальный диафрагмальный дефект после вправления желудка.
Часто желудок возвращается в грудную полость, если его не удерживать, поэтому спайки между желудком и грыжевым мешком необходимо разделить для улучшения доступа.
При более сложных грыжах в грудной полости также могут находиться ободочная кишка и другие структуры.

Рис. 7-6. Диссекцию грыжевого дефекта начинают над правой ножкой и продолжают в направлении левой. По ходу мышцы оставляют ободок брюшины для облегчения закрытия дефекта.

Рис. 7-7. Проводят тщательную диссекцию грыжевого мешка от структур средостения. Слой по большей части тонкий. Поверхность плевры часто представлена белой линией, необходимо избегать ее повреждения для профилактики пневмоторакса. Эта диссекциия может быть проведена с помощью электроножа, ультразвуковой диссекции или биполярного устройства. Необходимо с осторожностью проводить диссекциию рядом с пищеводом, чтобы случайно его не повредить. Стволы блуждающего нерва также необходимо обнаружить и сохранить.

Рис. 7-8. Верхние короткие желудочные сосуды пересекают чтобы облегчить мобилизацию дна для фундопликации.
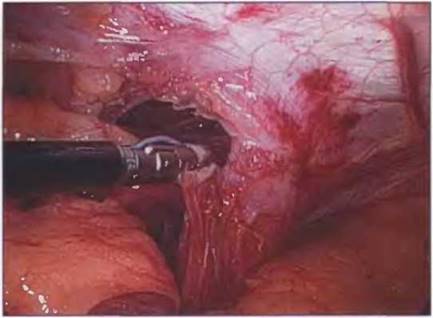
Рис. 7-9. После пересечения коротких сосудов желудка диссекцию продолжают вдоль левой ножки. После полного вправления грыжевой мешок может быть полностью удален или оставлен интактным. Удаление мешка облегчает фундопликацию, но делать это следует с осторожностью, чтобы избежать повреждения желудка. Иногда (при больших грыжах) полное удаление грыжевого мешка невозможно.
В этих случаях мешок необходимо рассечь по кругу.

Рис. 7-10. А и Б — пищеводный ретрактор способствует обнажению дефекта ножек.

Рис. 7-11. Пластика дефекта ножек с использованием отдельных нерассасывающихся швов завершена кзади от пищевода. После завершения пластики пищеводное отверстие диафрагмы должно свободно пропускать зажим, прилежащий к пищеводу.

Рис. 7-12. Для укрепления задней крурорафии применяют сетку (on log). В основном авторы предпочитают биорастворимую сетку, чтобы не оставлять в тканях инородного тела. Если дефект невозможно зашить, пластику сеткой необходимо провести обязательно, а не опционно.

Рис. 7-13. Завершенная пластика с фиксированной сеткой.
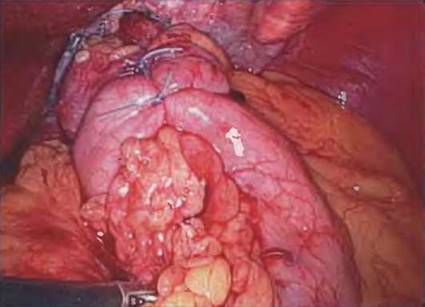
Рис. 7-14. Фундопликация и гастропексия к передней брюшной стенке завершают операцию. Также возможна установка гастростомической трубки.

Рис. 7-15. Модифицированная гастропластика по Коллису с резекцией края угла Гиса и внутригрудного пищевода. Лапароскопическую операцию по Коллису проводят над пищеводным бужом.
СПИСОК ЛИТЕРАТУРЫ
1. Hochberg L.A. Thoracic Surgery before the 20th Century. — New York: Vantage Press, I960.
2. Ritvo M. Hernia of the stomach through the esophageal orifice of the diaphragm // JAMA. — 1930. — Vol. 94. — P. 15-21.
3. Moore A.B., Kirklin B.R. Progress in the roentgenological diagnosis of diaphragmatic hernia // JAMA. — 1930. — Vol. 95. — P. 1966- 1969.
4. Athanasakis H., Tzortzinis A., Tsiaoussis J. et al. Laparoscopic repair of paraesophageal hernia // Endoscopy. — 2001. — Vol. 33. — P. 590-594.
5. Weiss III C. A., Stevens R.M., Schwartz R.W. Paraesophageal hernia: current diagnosis and treatment // Curr. Surg. — 2002. — Vol. 59. — P. 180-182.
6. Terry M., Smith C.D., Branum C.D. et al. Outcomes of laparoscopic fundo-plication for gastroesophageal reflux disease and paraesophageal hernia // Surg. Endosc. — 2001. — Vol. 15. — P. 691-699.
7. Mattar S.G., Bowers S.P., Galloway K.D. et al. Long-term outcome of laparoscopic repair of paraesophageal hernia // Surg. Endosc. — 2002. — Vol. 16. — P. 745-749.
8. Pierre A.F., Luketich J.D., Fernando H.C. et al. Results of laparoscopic repair of giant paraesophageal hernias: 200 consecutive patients // Ann. Thorac. Surg. — 2002. — Vol. 74. — P. 1909-1915.
9. Ferri L.E., Feldman L.S., Stanbridge D. et al. Should laparoscopic paraesophageal hernia repair be abandoned in favor of the open approach? // Surg. Endosc. — 2005. — Vol. 19. — P. 4-8.
10. Draaisma W.A., Gooszen H.G., Tournoij E. et al. Controversies in paraesophageal hernia repair: a review of literature // Surg. Endosc. — 2005. — Vol. 19. — P. 1300-1308.
11. Lai D.R., Pelligrini C.A., Oelschalger B.K. Laparoscopic repair of paraesophageal hernia // Surg. Clin. North Am. — 2005. — Vol. 85. — P. 105-118.
12. Terry M.L., Vernon A., Hunter J.G. Stapled-wedge Collis gastroplasty for the shortened esophagus // Am. J. Surg. — 2004. — Vol. 188. — P. 195-199.
13. Granderath F.A., Schweiger U.M., Kamolz T. et al. Laparoscopic Nissen fundoplication with prosthetic hiatal closure reduces postoperative intra-thoracic wrap herniation: preliminary results of a prospective randomized functional and clinical study // Arch. Surg. — 2005. — Vol. 140. — P. 40-48.
14. Frantzides C.T., Madan A.K., Carlson M. A. et al. A prospective, randomized trial of laparoscopic polytetrafluoroethylene (PTFE) patch repair vs. simple cruroplasty for large hiatal hernia // Arch. Surg. — 2002. — Vol. 137. — P. 649-652.
15. Oelschlager B.K., Pelligrini C. A., Hunter J. et al. Biologic prosthesis reduces recurrence after laparoscopic paraesophageal hernia repair: a multicenter, prospective, randomized trial // Ann. Surg. — 2006. — Vol. 244. — P. 481-490.
16. Ellis F.H., Jr., Crozier R.E., Shea J.A. Paraesophageal hiatus hernia // Arch. Surg. — 1986. — Vol. 121. — P. 416-420.
17. Lai D.R., Pellegrini C.A., Oelschlager B.K. Laparoscopic repair of paraesophageal hernia // Surg. Clin. North Am. — 2005. — Vol. 85. — P. 105-118.