Несмотря на то что клинические анализы крови и мочи, биохимические анализы крови, анализы желчи и кала - неспецифические методы исследования в инфектологии, их результаты имеют большое значение в диагностике, дифференциальной диагностике и прогнозировании инфекционных болезней. В настоящем разделе представлены наиболее распространенные показатели, используемые в практике инфекциониста.
КЛИНИЧЕСКИЙ АНАЛИЗ КРОВИ
КЛИНИЧЕСКИЙ АНАЛИЗ МОЧИ
БИОХИМИЧЕСКИЙ АНАЛИЗ КРОВИ
АНАЛИЗ ЖЕЛЧИ
КЛИНИЧЕСКИЙ АНАЛИЗ КАЛА
ИССЛЕДОВАНИЕ СПИННОМОЗГОВОЙ ЖИДКОСТИ
СПЕЦИАЛЬНЫЕ МЕТОДЫ
ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
Методы лабораторной диагностики, используемые в клинике инфекционных болезней, разделяют на две большие группы - общеклинические и специальные. В данном разделе речь пойдет о специальных методах, направленных на установление этиологии заболевания, идентификацию его возбудителя и определение специфических биомаркеров инфекционного процесса.
К специальным методам лабораторной диагностики инфекционных болезней относят микроскопический, микробиологический, вирусологический, биологический, иммунологический, молекулярно-биологический и комбинированные методы.
Основной задачей микроскопического метода исследования является индикация возбудителя в биологическом материале от больного и в ряде случаев - определение его видовой принадлежности.
В процессе микроскопического исследования выявляются две категории свойств возбудителя - его морфология и отношение к окраске, которые не относятся к видовым признакам микроорганизма, а характеризуют лишь его родовую принадлежность. В связи с этим микроскопия не позволяет в большинстве случаев определить вид возбудителя и поставить на этом основании диагноз заболевания. Только при сочетании микроскопического метода с методами иммунодиагностики возможна идентификации возбудителя.
Современная микроскопия в зависимости от способа визуализации микроорганизмов базируется на трех принципах - световом, электронном, лазерном.
Световая микроскопия позволяет исследовать как нативные препараты из биологического материала, так окрашенные препараты (рис. 6.3).
В нативных препаратах определяют не только морфологию возбудителя, но и его подвижность (спирохеты, амебы, холерные вибрионы и др.). В фиксированных и окрашенных красителями мазках выявляют тинкториальные свойства возбудителя, то есть наличие у него определенных химических структур, приобретающих под воздействием специального красителя определенную окраску. Наиболее распространенный способ окраски бактерий - окраска по Граму, которая позволяет выявлять в составе их клеточной стенки высокое содержание пептидогликана, усваивающего один из красителей. В результате бактерии с высоким содержанием пептидогликана окрашиваются в фиолетовый цвет - грамположительные бактерии, а с низким в красный цвет - грамотрицательные бактерии. Такое разделение бактерий имеет очень важное значение в их систематике, оценке патогенных свойств и чувствительности к химиотерапевтическим средствам. Например, патогенные грамположительные бактерии в большинстве случаев образуют экзотоксины, грамотрицательным бактериям присуще содержание липополисахарида (эндотоксина) в составе клеточной стенки. Кроме того, существует взаимосвязь между окраской по Граму и возможностью проникновения конкретного антибиотика или другого химиопрепарата в бактериальную клетку с реализацией его внутриклеточного эффекта.
В оптической микроскопической технике нашло применение и явление люминесценции микроскопических объектов как естественное, так и вызванное специальными красителями-флюорохромами (люминесцентная микроскопия).
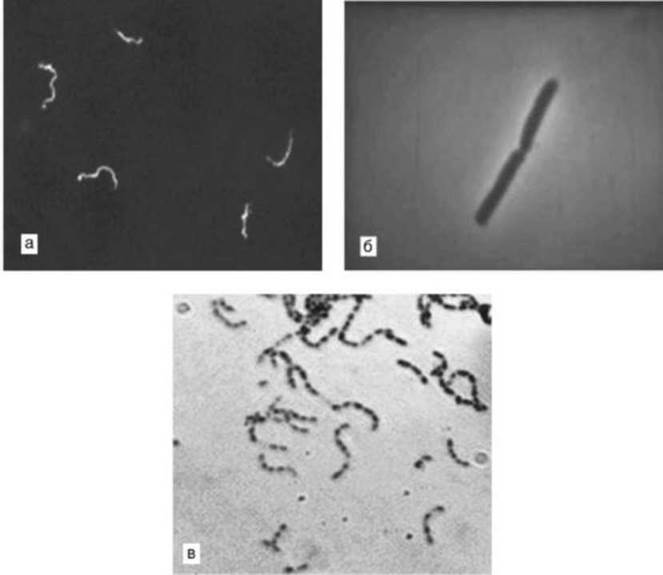
Рис. 6.3. Препараты для микроскопии: а, б - нативные препараты для изучения подвижности микроорганизмов методами темнопольной (а) и фазовоконтрастной (б) микроскопии; в - фиксированный и окрашенный мазок для иммерсионной микроскопии

Рис. 6.4. Современные оптические микроскопы и видеосистемы
Что касается используемой в оптической микроскопии техники, то она представлена широким набором микроскопов - от традиционных до сложных видеосистем, позволяющих применять любой из существующих видов микроскопии и выводить изображение на экран монитора (рис. 6.4).
Световая микроскопия до настоящего времени используется в диагностике гельминтозов, инфекций, вызванных простейшими и грибами. Этот метод сохраняет свое значение при обнаружении в биологическом материале бактерий и бактериеподобных микроорганизмов - микобактерий, вибрионов, бактерий кокковой группы, спирохет, актиномицетов, т.е. таких микробов, размеры которых, уникальные тинкториальные свойства или характерная подвижность позволяют оптически зарегистрировать их присутствие в материале от больного.
Комбинация световой микроскопии с иммунологическим методом в виде обработки микроскопических препаратов антителами, меченными флюорохромами, к наиболее характерным видовым микробным антигенам последующей люминесцентной микроскопией значительно повышает ее диагностическую значимость. Эти методы еще будут охарактеризованы в последующем как разновидность иммуноанализа - иммунофлюоресцентный или иммуногистохимический методы.
Значительно реже в инфекционной практике используется электронная или конфокальная микроскопия - микроскопический метод, в котором вместо светового потока для визуализации микроскопических объектов используется поток электронов или лазерные лучи, позволяющие тысячекратно увеличить разрешающую способность метода и обнаруживать в биологическом материале не только клеточные микроорганизмы, но и вирусы (рис. 6.5). Однако высокая стоимость таких микроскопов, сложность их обслуживания резко ограничивают их применение в диагностике инфекционных заболеваний. Гораздо шире электронная и конфокальная микроскопия используются с научно-исследовательскими целями.
Преимущества микроскопического метода заключаются в его широкой доступности и возможности использования для ранней предварительной диагностики бактериальных инфекций. Однако при протозоозах и грибковых инфекциях диагностическое значение микроскопии резко возрастает, а при гельминтозах, например, последняя становится практически единственным методом диагностики. Микроскопический метод может использоваться и в диагностике вирусных инфекций, но в этом случае обнаруживают не отдельного возбудителя, имеющего чрезвычайно малые размеры, а внутриклеточные включения - скопления возбудителя в клетках макроорганизма или продуктов измененного метаболизма клетки. В табл. 6.6-6.8 представлены основные принципы микроскопической диагностики при инфекционных заболеваниях, где этот метод играет значительную роль.
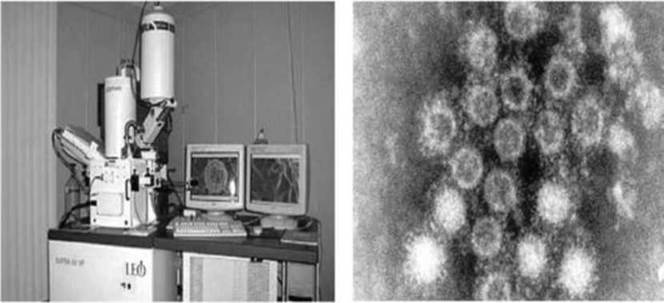
Рис. 6.5. Электронный микроскоп (слева) и вирус гепатита А в биоматериале при электронной микроскопии (справа)
Таблица 6.6. Микроскопический метод в диагностике заболеваний, вызываемых гельминтами
|
Гельминтоз |
Возбудитель |
Исследуемый материал |
Препараты для микроскопии |
Объекты микроскопического обнаружения |
|
Нематодозы |
||||
|
Аскаридоз |
Ascaris Iumbricoides |
Кал |
Нативный препарат |
Оплодотворенные и неоплодотворенные яйца |
|
Трихоцефалез |
Trichocephalus trichiurus |
Кал |
Нативный препарат |
Яйца |
|
Энтеробиоз |
Enterobius vermicularis |
Соскоб с периа- нальной складки |
Нативный препарат |
Яйца, возбудитель |
|
Стронгилоидоз |
Strongyloides stercoralis |
Кал, дуоденальное содержимое |
Нативный препарат |
Личинки |
|
Трихинеллез |
Trichinella spiralis |
Мясные продукты, биоптаты мышечной ткани, секционный материал |
Нативный препарат |
Личинки |
|
Токсокароз |
Toxocara canis |
Биопсийный и секционный материал |
Нативный препарат |
Личинки |
|
Цестодозы |
||||
|
Дифиллоботриоз |
Diphyllobothrium latum |
Кал |
Нативный препарат |
Яйца, членики |
|
Тениаринхоз |
Taeniarhynchus saginatus |
Кал, соскобс перианальной складки |
Нативный препарат |
Яйца, членики |
|
Тениоз |
Taenia solium |
Кал |
Нативный препарат |
Яйца, членики |
|
Цистицеркоз |
Cysticersus cellulosae |
Биопсийный материал |
Нативный препарат |
Личинки (цистицерки) |
|
Эхинококкоз |
Echinococcus granulosus |
Содержимое паразитарной кисты, мокрота, лаважная жидкость, желчь, биопсийный материал |
Нативный препарат |
Протосколексы, ацефалокисты |
|
Трематодозы |
||||
|
Описторхоз |
Opisthorchis felineus |
Кал, желчь |
Нативный препарат |
Яйца |
|
Фасциолез |
Fasciola hepatica, Fasciola gigantica |
Кал, желчь |
Нативный препарат |
Яйца |
|
Шистосомоз мочеполовой и кишечный |
Schistosoma haematobium, Schistosoma mansoni |
Моча, кал |
Нативный препарат |
Яйца |
|
Таблица 6.7. Микроскопический метод в диагностике заболеваний, вызываемых простейшими |
||||
|
Протозооз |
Возбудитель |
Исследуемый материал |
Способ микроскопического обнаружения |
Объекты микроскопического обнаружения |
|
Амебиаз |
Entamoeba histolytica |
Свежий кал |
Нативные препараты (с добавлением раствора Люголя и метиленового синего) и окрашенные мазки |
Трофозоиты, у реконвалесцентов и носителей - просветная форма, цисты |
|
Протозооз |
Возбудитель |
Исследуемый материал |
Способ микроскопического обнаружения |
Объекты микроскопического обнаружения |
|
Лямблиоз |
Giardia intestinalis |
Желчь, кал |
Нативный препарат |
Трофозоиты, цисты |
|
Малярия |
Plasmodium vivax, Plasmodium malariae, Plasmodium falciparum, Plasmodium ovale |
Кровь |
Мазок «толстая капля» без фиксации, окраска по Романовскому-Гимзе |
Трофозоиты, шизонты, эритроцитарные мерозоиты, микро-гаметоциты, макрогаметоциты |
|
Токсоплазмоз |
Toxoplasma gondii |
Спинномозговая плевральная, околоплодная жидкость, кровь, биоптаты лимфатических узлов |
Фиксированные мазки с окраской по Романовскому-Гимзе |
Трофозоиты, псевдоцисты, в тканях - цисты |
|
Лейшманиоз |
Leishmania tropica, Leishmania donovani и др. (около 20 видов) |
Отделяемое с краев язвы, кровь, пункта-ты внутренних органов, лимфатических узлов |
Фиксированные мазки, окрашенные по Романовскому-Гимзе |
Безжгутиковые формы возбудителя |
|
Трихомониаз мочеполовой, кишечный |
Trichomonas vaginalis, Trichomonas hominis |
Свежее отделяемое влагалища и уретры, кал |
Нативный препарат |
Возбудитель |
|
Бабезиоз |
Babesia divergens, Babesia rodhaini, Babesia micron |
Кровь |
Мазок «толстая капля» без фиксации, окраска по Романовскому-Гимзе |
Возбудитель |
|
Трипаносомоз |
Trypanosoma brucei, Trypanosoma cruzi |
Пунктат первичных аффектов, кровь |
Фиксированный мазок- отпечаток и мазок «толстая капля» крови без фиксации с окраской по Романовскому-Гимзе |
Возбудитель |
|
Балантидиаз |
Balantidium coli |
Кал |
Нативный препарат |
Трофозоиты, цисты |
|
Таблица 6.8. Микроскопический метод в диагностике заболеваний, вызываемых грибами |
||||
|
Микоз |
Возбудитель |
Исследуемый материал |
Способ микроскопического обнаружения |
Объекты микроскопического обнаружения |
|
Кератомикозы |
||||
|
Отрубевидный лишай |
Pityrosporum obiculare |
Чешуйки кожи |
Обработанный щелочью нативный препарат |
Мицелий и характерное скопление гифов гриба |
|
Дерматофитии |
||||
|
Трихофития, фавус |
Trichophyton |
Чешуйки кожи, волосы, соскобы с ногтей |
Обработанный щелочью нативный препарат |
Характерные споры грибов (в волосах), мицелий и споры гриба |
|
Микоз |
Возбудитель |
Исследуемый материал |
Способ микроскопического обнаружения |
Объекты микроскопического обнаружения |
|
Микроспория |
Microsporum |
Чешуйки кожи, волосы, соскобы с ногтей |
Обработанный щелочью нативный препарат |
Характерные споры грибов (в волосах), мицелий и споры гриба |
|
Эпидермофития |
Epidermophyton floccosum |
Чешуйки кожи, соскобы с ногтей |
Обработанный щелочью нативный препарат |
Характерные мицелий и споры гриба |
|
Кандидозы |
||||
|
Кандидоз кожи, слизистых оболочек, инвазивный кандидоз |
Candida albicans, Gandida tropicalis, Gandida cate-nulara, Candida cijferrii, Candida guilliermondii и др. |
Соскобы кожи, налет слизистых оболочек, моча, мокрота, кал, кровь, пунктаты внутренних органов |
Нативные препараты, фиксированные препараты с окраской по Граму и др. окраски |
Дрожжевые почкующиеся клетки, псевдомицелий |
|
Оппортунистические микозы |
||||
|
Криптококкоз |
Cryptococcus neoformans |
Мокрота, гной, соскобы язв, СМЖ, моча, биоптаты тканей |
Нативные препараты, фиксированные-мазки, окрашенные тушью |
Округлые или яйцевидные клетки, окруженные слизистой желтоватой капсулой |
|
Плесниевые микозы |
Aspergillu spp., Mucor spp., Penicillium spp., Fusarium spp. |
Соскобы с кожи, ногтей, отделяемое пазух носа, наружного слухового прохода, мокрота, гной, кал, биоптаты тканей |
Фиксированные препараты с окраской по Граму |
Характерное расположение мицеллия и конидиоспор |
|
Пневмоцистоз |
Pneumocystis jiroveci |
Мокрота, лаважная жидкость, биоптаты легочной ткани |
Фиксированные мазки с окраской по Романовскому-Гимзе |
Возбудитель |
|
Глубокие микозы |
||||
|
Кокцидиоидоз |
Coccidioides immitis |
Гной, мокрота, кровь, ликвор, биопсийный материал |
Нативные препараты, фиксированные препараты с окраской по Граму |
Сферула как тканевая форма |
|
Гистоплазмоз |
Histoplasma capsulatum, Histoplasma duboisii |
Гной, мокрота, кровь, моча, ликвор, пункта? внутренних органов |
Фиксированные мазки с окраской по Романовскому-Гимзе |
Овальные дрожжеподобные клетки внеклеточно или внутри моноцитов/макрофагов |
|
Бластомикоз |
Blastomyces dermatitidis |
Гной из свищей и абсцессов, ликвор, мокрота, моча, пун-ктат лимфатических узлов |
Обработанный щелочью нативный препарат |
Круглые или овальные крупные дрожжевые клетки с двухконтурной клеточной стенкой |
Микробиологический метод до настоящего времени остается одним из ведущих методов лабораторной диагностики целого ряда инфекционных заболеваний.
Суть метода заключается в выделении чистой культуры микробного возбудителя из материала от больного с его последующей идентификацией.
Наиболее часто микробиологический метод используется в диагностике бактериальных инфекций (бактериологический метод), микозов (микологический метод), в этом случае чистую культуру получают путем посева на искусственные питательные среды.
Выделить чистую культуру вирусов путем посева на искусственные питательные среды не удается, так как вирусы размножаются только в живых клетках. Для этой цели используют культуры тканей, куриные эмбрионы, что входит в понятие - вирусологического - метода диагностики.
Бактериологический метод служит одним из самых широко используемых методов в диагностике бактериальных инфекций. Алгоритм его осуществления представлен на рис. 6.6, а его отдельные этапы - на рис. 6.7.
Эффективность бактериологического метода диагностики зависит от ряда обстоятельств.
Во-первых, необходимо учитывать сроки отдельных стадий патогенеза инфекционного процесса, которые влияют на присутствие возбудителя в исследуемом биологическом материале. Например, при брюшном тифе чаще всего удается выделить гемокультуру возбудителя в первые дни лихорадки, поскольку в последующие дни интенсивность бактериемии значительно снижается, как и возможность выделения чистой культуры возбудителя из крови, в то же время на 2-3 нед болезни резко повышается возможность получения копрокультуры возбудителя. При менингококковой инфекции бактериемия наиболее интенсивна в первые часы болезни, а в течение вторых и третьих суток резко падает даже в отсутствие антибактериальной терапии.
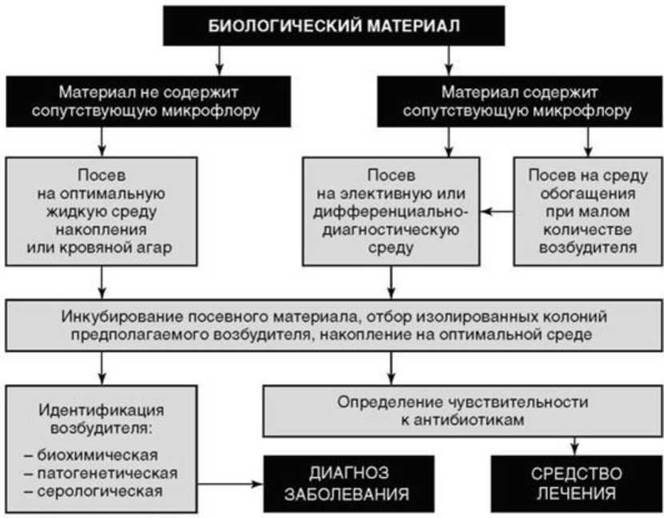
Рис. 6.6. Алгоритм бактериологического метода

Рис. 6.7. Этапы накопления чистой культуры и ее идентификации
Во-вторых, существенное значение для эффективности бактериологической диагностики имеет соблюдение правил забора материала для исследования. Так, забор крови, мочи, слизи, кала должен осуществляться в стерильную посуду, которая перед этим обеззараживалась путем термической обработки, но не с использованием дезинфицирующих средств. При этом очень важно производить забор биологического материала из места наиболее вероятного нахождения возбудителя - краев налетов на миндалинах, кожных поражений, язв кишечника, спинномозговой жидкости, пунктата гнойных очагов. Наружные покровы в месте забора материала (из вены, артерии, местного очага) должны быть тщательно обработаны (настойкой йода, 96% этиловым спиртом) во избежание попадания в просвет иглы аутофлоры.
Очень важное значение имеет отсутствие в исследуемом материале ингибиторов роста бактерий, прежде всего, антибиотиков, которые резко снижают (не менее чем в 2-3 раза) вероятность высева возбудителя. По этой причине бактериологическое исследование нужно производить немедленно при поступлении больного независимо от времени суток до назначения антибиотиков.
В бактериологической диагностике играет существенную роль рациональный подбор питательных сред для исследования в соответствии с предполагаемым возбудителем и их качество: среда должна быть сертифицирована, приготовлена с соблюдением технологии, храниться при соответствующей температуре в пределах срока годности.
Материал для бактериологического исследования должен доставляться в лабораторию с соблюдением правил транспортировки. Наилучшими способами предупредить гибель предполагаемого возбудителя является посев на основную питательную среду или на транспортную среду у постели больного. В остальных случаях следует максимально сократить сроки доставки материала в лабораторию, предохранить его от загрязнения, охлаждения и высыхания. Для этого взятый для исследования материал хранится в стерильной посуде с герметичной крышкой в термостате при 37 °С, перевозится при той же температуре в термосе или другом транспортном обогревателе.
Очень важной составляющей частью бактериологической диагностики является определение чувствительности возбудителя к антибиотикам, способы которого довольно разнообразны (рис. 6.8).
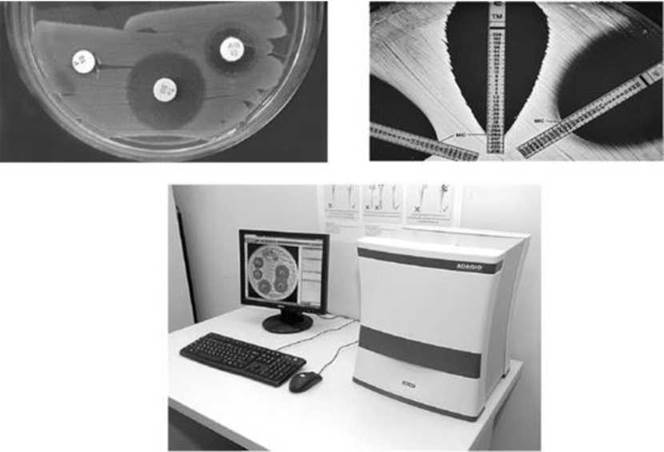
Рис. 6.8. Определение чувствительности бактерий к антибиотикам
Несмотря на многообразие существующих методов и их оценки для выявления наиболее эффективных антибиотических препаратов для лечения инфекционных заболеваний, существуют определенные проблемы в реализации этой части бактериологического исследования. Главная из них заключается в том, что выделение чистой культуры, предшествующее определению чувствительности к антибиотикам, занимает относительно большой период времени - в среднем около 23 дней. В связи с этим такие важные для лечебного процесса сведения поступают к врачу с большим опозданием. По этой причине особый интерес вызывают автоматизированные способы определения чувствительности возбудителя к антибиотикам.
Приборы, используемые для определения чувствительности к антибиотикам, позволяют работать не только с чистой культурой, но и с исходным биологическим материалом. В этом случае определение лекарственной устойчивости возбудителя происходит автоматически без выяснения видовой принадлежности возбудителя и исследование занимает от 2 до 6 ч.
Микологический метод, применяемый в диагностике грибковых инфекций и также основанный на использовании искусственных питательных сред (Сабуро, Чапека и др.), имеет множество особенностей, отчасти отраженных в алгоритме получения чистых культур при микозах (рис. 6.9). Этот метод обязательно сочетают с микроскопическим исследованием, при этом особое значение придают диморфизму грибов - их способности по-разному проявлять свои свойства в паразитической и сапрофитической фазе.
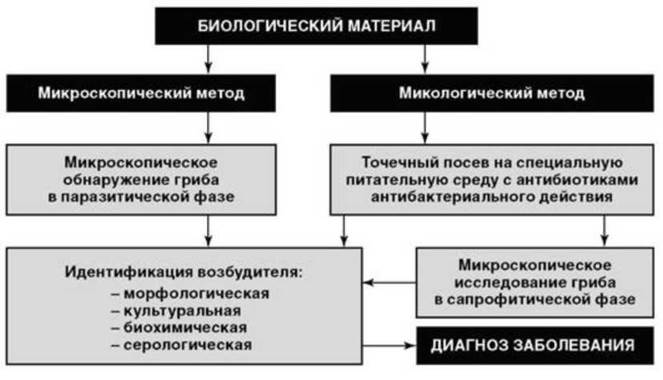
Рис. 6.9. Алгоритм микологического метода
Недостатком микологического метода следует считать довольно значительную продолжительность исследования, поскольку грибы растут на питательных средах значительно медленней бактерий. В связи с этим микологическое исследование растягивается до 6-10 дней.
Вирусологический метод отличается тем, что биологический материал, предположительно содержащий вирусы, используется для заражения куриного эмбриона, культуры клеток или культуры органов лабораторных животных, что принципиально изменяет алгоритм проводимого исследования (рис. 6.10).
Если исследуемый материал содержит постороннюю микрофлору, его предварительно обрабатывают антибиотиками. Культивирование куриных эмбрионов после их заражения осуществляется в течение 5-8 дней, культур тканей - в течение 56 дней, а общая продолжительность вирусологического исследования составляет до 3 нед, что в большинстве случаев позволяет поставить лишь ретроспективный диагноз.
Такие феномены как цитопатогенное действие вируса на ткани, используемые для культивирования, бляшкообразование (образование очагов разрушения тканей), цветная проба (отсутствие закономерного изменения цвета среды при наличии живого возбудителя), полученные при различных разведениях биологического материала для заражения, позволяют не только обнаружить вирус, но и определить его примерное количество, т.е. провести титрование вируса.
Завершается вирусологический метод идентификацией вируса с помощью таких серологических реакций как реакция нейтрализации (РН) действия вируса на живую ткань, реакция торможения гемагглютинации (РТГА) куриных эритроцитов, реакция связывания комплемента (РСК), реакция иммунофлюоресценции (РИФ), ИФА.
Оценивая диагностическое значение вирусологического метода у постели следует подчеркнуть, что оно невелико из-за длительности диагностического исследования, необходимости содержать специализированную вирусологическую лабораторию строгого режима. В связи с этим вирусологический метод чаще используют для мониторинга циркулирующих штаммов различных вирусов, в частности вирусов гриппа, гепатитов.
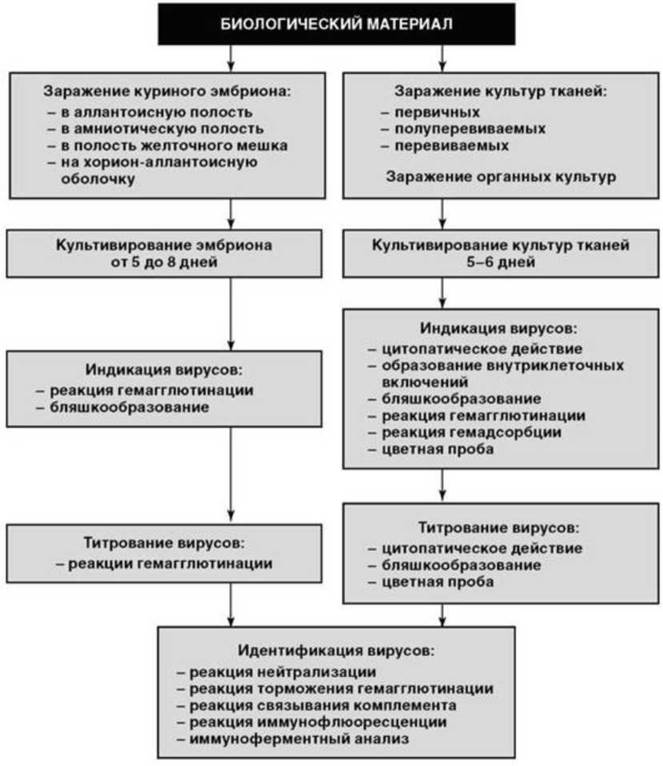
Рис. 6.10. Алгоритм вирусологического метода
Биологический метод (биопроба) заключается в выделении возбудителя из биологического материала или идентификации его токсинов путем заражения лабораторных животных, высоко восприимчивых к данному возбудителю и чувствительных к действию его токсинов. В современных условиях метод биопроб в силу своей дороговизны и опасности применяется преимущественно как первый этап обнаружения и идентификации возбудителей особо опасных инфекций.
Несмотря на то, что среди диагностических возможностей этого метода ранее отмечали выделение и идентификацию чистой культуры, в настоящее время биологический метод с этой целью не используют, а применяют для накопления или обогащения биологического материала соответствующим микроорганизмом.
Биологический метод имеет ведущее значение при идентификации бактериальных экзотоксинов (ботулинического, столбнячного).
На основе биопробы можно воспроизводить такие серологические реакции как РН токсина или РН вируса, которые позволяют не только идентифицировать возбудителя, но и способствуют обнаружению антител к экзотоксинам или вирусам.
Иммунологические методы лабораторной диагностики инфекционных заболеваний занимают значительное место в клинической практике и могут иметь как самостоятельное, так и вспомогательное значение.
Задачи, решаемые иммунодиагностическими методами, довольно разнообразны по целям постановки и включают сероиндикацию и сероидентификацию возбудителей, а также серодиагностику и аллергодиагностику инфекционных болезней (рис. 6.11).
Сероиндикация - обнаружение возбудителя в биологическом материале от больного на основе применения специфических антител к его видовым антигенам. Как диагностическое направление, сероиндикация широко используется при экспресс- диагностике различных инфекционных заболеваний, а ее значение в верификации диагноза определяется качеством препарата из специфических антител и способом регистрации результата исследования.
Сероидентификация не является самостоятельным методом диагностики инфекционных заболеваний, а является этапом бактериологического или вирусологического методов, связанным с определением вида организма по его видовым антигенам. Этому исследованию предшествует выделение чистой культуры возбудителя, а сам процесс идентификации включает использование препаратов специфических видов антител.
Серодиагностика - постановка диагноза путем обнаружения антител к возбудителю в сыворотке крови и других биологических жидкостях как специфических биомаркеров инфекционного процесса. Методическая основа такого диагностического исследования не очень однозначна в интерпретации. Она требует учета возможности попадания возбудителя и, соответственно, выработки антител к нему в анамнезе, а также факта высокой вероятности присутствия в организме больного «нормальных» антител, способных давать перекрестные реакции с антигенами искомого патогенного микроорганизма. Несмотря на это современная серодиагностика составляет значительную часть исследований по верификации диагноза в клинике инфекционных болезней.
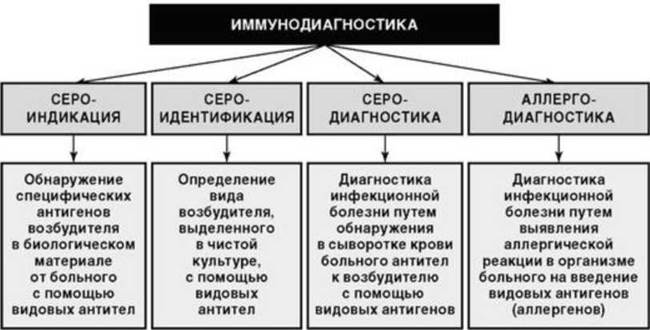
Рис. 6.11. Назначение методов иммунодиагностики
Аллергодиагностика основана на ориентировочном диагностировании инфекционного процесса путем регистрации местной аллергической реакции, развивающейся на коже в месте введения микробного аллергена. Тем не менее при некоторых видах инфекционной патологии этот метод до настоящего времени не потерял своего диагностического значения как скринингового теста.
Итак, направления диагностических исследований с использованием иммунологических методов довольно разнообразны, как и сами способы воспроизведения иммунологических тестов. Условно среди приемов иммунодиагностики можно выделить следующие методы:
методы с использованием феномена перекрестного взаимодействия иммунных комплексов [реакции агглютинации (РА), пассивной (непрямой) гемагглютинации, латекс-агглютинации, торможения гемагглютинации, преципитации];
методы с использованием феномена комплементарного лизиса (РСК, РА и лизиса);
методы, основанные на нейтрализующем действии антител (РН токсина, РН вируса); аллергические методы (внутрикожные пробы с микробными аллергенами);
методы иммуноанализов (иммунофлюоресцентный анализ, радиоиммунный анализ, ИФА).
Среди методов с использованием феномена перекрестного взаимодействия иммунных комплексов наиболее доступными являются методы, основанные на феномене агглютинации.
Сущность РА заключается в том, что в присутствии электролита иммунные комплексы, содержащие корпускулярные частицы антигена и антитела, сшиваются между собой и выпадают в виде зернистого или хлопьевидного осадка, что регистрируется визуально.
Наиболее часто РА используется в диагностике бактериальных инфекций. Если в состав иммунных комплексов при данной реакции входят бактериальные клетки, то это собственно агглютинация. В РА могут участвовать различные поверхностные антигены бактерий: компоненты их клеточной стенки (О-антигены), жгутики бактерий (Н-антигены), элементы капсулы (К-антигены).
При диагностике некоторых инфекций это имеет принципиальное значение.
Например, сальмонеллы, классификация которых включает более 2 тыс. видов, в том числе более 700 видов, патогенных для человека, содержат как О-антигены, так и Н- антигены. Их идентификация по антигенной структуре проводится в соответствии с классификацией, разработанной Кауфманом и Уайтом. По этой схеме все сальмонеллы по О-антигенам разделены на группы: A, B, C, D, E и т.д. Каждая группа включает различное число видов сальмонелл, определить которые можно, исходя из того, что Н-антигены сальмонелл обладают видовой специфичностью. Пользуясь схемой Кауфмана-Уайта, вначале в РА используют О-сыворотки и устанавливают группу, к которой принадлежит культура сальмонелл, выделенная из организма больного, а на следующем этапе с помощью Н-сывороток в РА определяют вид возбудителя, что значительно упрощает процесс идентификации.
Если микробные антигены искусственно адсорбированы на поверхности эритроцитов, то такая реакция носит название пассивной (или непрямой) гемагглютинации (РПГА или РНГА). Если микробные антигены адсорбированы на поверхности латекса - это латекс-агглютинация.
РА широко используется не только для сероидентификации бактерий, но и для серодиагностики бактериальных инфекций. При этом РПГА и латекс-агглютинации применяются исключительно для серодиагностики. Для предотвращения ложноположительных результатов реакции из-за наличия в сыворотке больного «нормальных» антител было введено понятие диагностического титра.
Необходимость такого диагностического приема связана с тем, что уровень нормальных антител обычно невелик, а уровень специфических антител к возбудителю при наличии инфекционного заболевания значительно выше, в связи с этим существует пограничное разведение сыворотки больного, начиная с которого реакцию, основанную на феномене агглютинации, можно считать положительной. Это пограничное разведение сыворотки больного и получило название диагностического титра. Величина диагностического титра зависит от возбудителя, а также вида серологической реакции. Так, например, для брюшного тифа диагностический титр РА составляет 1:200, а для сыпного тифа 1:100, а для РПГА при брюшном тифе 1:40 и т.д. (табл. 6.9). Основанием для того, чтобы считать ту или иную реакцию положительной, является превышение диагностического титра при постановке реакции не менее. чем в 2-4 раза.
В то же время, если человек уже болел тем инфекционным заболеванием, диагностика которого проводится в настоящий момент, для исключения ложноположительного результата - исследование проводят с парными сыворотками, полученными с интервалом от 7 до 14 дней. Диагностически значимым считается нарастание титра антител при исследовании парных сывороток не менее чем в 4 раза, или снижение титра при постановке реакции в поздние сроки болезни.
В некоторых случаях, например при бруцеллезе, антитела сыворотки больного не дают феномена агглютинации - так называемые неполные антитела. Для их выявления реакцию ставят в два этапа. На первом этапе к сыворотке больного добавляют, как обычно, бактериальный диагностикум (взвесь бруцелл), а на втором этапе в тест-систему вносят сыворотку, полученную иммунизацией животных иммуноглобулинами человека. После соответствующей очистки эта сыворотка содержит в своем составе антитела к иммуноглобулинам человека, способные давать в случае формирования иммунного комплекса феномен агглютинации. В результате, если в сыворотке больного содержатся неполные антитела, то они присоединяются к бруцеллам в составе диагностикума, а к ним, в свою очередь, антитела к иммуноглобулинам человека. В конечном итоге эти «тройные» комплексы в растворе электролита (обычно физрастворе) объединяются между собой и выпадают в осадок. Такая реакция по выявлению неполных антител получила название реакции Кумбса.
РА в различных вариантах ее постановки может использоваться не только при бактериальных инфекциях, а также при некоторых микозах и заболеваниях, вызванных простейшими (табл. 6.9-6.11).
При заболеваниях вирусной природы постановка РА невозможна из-за мелких размеров вируса. В то же время при вирусных инфекциях используют один из вариантов реакции, связанных с явлением гемагглютинации куриных эритроцитов вирусами. В основе такой серологической реакции лежит способность противовирусных антител блокировать у вируса гемагглютинирующие свойства, а сам диагностический прием носит название РТГА. Эту реакцию воспроизводят как для идентификации вируса, полученного при вирусологическом исследовании, так и для серодиагностики вирусных инфекций путем обнаружения антител в сыворотке больного (табл. 6.11).
В число методов с использованием феномена перекрестного взаимодействия иммунных комплексов входит и реакция преципитации с тем отличием от описанных выше методов, что антиген в ней имеет молекулярную форму и образует прозрачный раствор. В присутствии антител и электролита иммунные комплексы сшиваются в конгломераты и вызывают помутнение среды. Чтобы зарегистрировать это помутнение существует несколько способов - реакция кольцепреципитации, реакция преципитации в геле, с помощью прибора нефелометра, позволяющего зарегистрировать даже слабую степень помутнения среды.
Реакция кольцепреципитации используется в инфекционно-эпидемиологической практике при необходимости обнаружения микробных антигенов или гаптенов на объектах внешней среды (реакция Асколи для обнаружения спор бациллы сибирской язвы) или в составе биологического материала от больного (реакция кольцепреципитации с гаптеном для обнаружения дизентерийной палочки в кале). Реакция обладает очень большой чувствительностью, позволяет зарегистрировать присутствии даже единичных микроорганизмов в исследуемом материале.
Другой разновидностью преципитации служит реакция преципитации в геле. В инфекционной практике она используется при определении токсигенности (способности выделять экзотоксинов) штаммов бактерий, выделенных из организма больного. Такая необходимость возникает, например, при бактериологической диагностике дифтерии, поскольку нетоксичные штаммы не вызывают заболевание и их присутствие в организме больного свидетельствует только о носительстве.
Среди методов с использованием феномена комплементарного лизиса наибольшей известностью пользуется РСК, учет которой производится по феномену гемолиза и которая широко используется для диагностики инфекций как бактериальной, так и небактериальной этиологии.
Реакция основана на том, что антитела в составе иммунных комплексов приобретают новое свойство - активировать систему комплемента, которая в процессе активации формирует мембрано-атакующий комплекс и вызывает лизис антигена, находящегося в комплексе с антителами.
РСК относится к рутинным методам, хотя и довольно сложна в постановке. Тем не менее ее продолжают широко использовать в клинике инфекционных болезней.
Система комплемента используется при диагностике лептоспироза на основе РА и лизиса лептоспир. При постановке этой реакции учет результатов проводят под микроскопом, наблюдая при положительном тесте не только процесс агглютинации живой культуры лептоспир, но и их комплементарный лизис.
В арсенале иммунодиагностики есть также методы, основанные на нейтрализующем действии антител, например, PH воспроизводится на живых объектах, восприимчивых к действию бактериальных экзотоксинов или вирусов. В соответствии с этим различают PH токсина и PH вирусов. Суть реакции заключается в том, что антитела, взаимодействуя с токсином или вирусом, препятствуют проявлению их патогенного воздействия на живой объект. PH можно использовать для индикации бактериальных токсинов в биологическом материале, идентификации вирусов, для серодиагностики вирусных инфекций.
Очень близкими к реакциям нейтрализации по механизму воспроизведения служат реакции иммобилизации, которые используют для идентификации возбудителей, обладающих подвижностью. Этот лабораторный прием применяют в диагностике сифилиса (реакция иммобилизации трепонем), а также холеры (иммобилизация холерного вибриона).
Еще один вариант - нейтрализация антителами сыворотки крови больного гемолитической активности стрептококкового стрептолизина-0 (АСЛО). Этот тест используется для диагностики инфекций, ассоциированных с гемолитическим стрептококком группы А.
Аллергическая проба. Для ее постановки человеку чаще всего внутрикожно вводится раствор микробных антигенов. Антигены взаимодействуют с эпителиальными клетками в месте введения, что способствует выделению хемокинов и привлечению к месту введения аллергена различных клеток иммунного ответа и прежде всего Т- лимфоцитов. Т-лимфоциты, которые под воздействием микробных антигенов выделяют провоспалительные цитокины. Все это в совокупности в течение 48 ч дает основные проявления положительной аллергической реакции - лимфоидномакрофагального инфильтрата в месте введения аллергена.
Аллергические пробы, хотя и носят лишь ориентировочный характер, очень удобны при массовых обследованиях на наличие таких инфекционных заболеваний как туберкулез, бруцеллез, токсопламоз. В этих случаях положительная аллергическая проба указывает на инфицированность организма и необходимость более точной диагностики инфекционного процесса.
К числу современных методов диагностики инфекционных заболеваний относятся методы иммуноанализа. Это особая группа методов, основанная на использовании меченых моноклональных антител. Моноклональные антитела получают с использованием так называемых гибридомных технологий, они высоко специфичны, поскольку способны к взаимодействию только с одной наиболее характерной антигенной детерминантой среди всего набора видовых микробных антигенов. Моноклональные антитела обычно метятся с помощью красителей-флюорохромов. Такие антитела, присоединяясь к специфичному для них объекту - искомому микроорганизму в составе биологического материала, вызывают его свечение в ультрафиолетовом свете, что может быть зарегистрировано, например, с помощью люминесцентного микроскопа. Этот способ обнаружения микробных возбудителей получил названия прямого иммунофлуоресцентного анализа (РИФ).
Этот способ используется не только для обнаружения возбудителей в составе материала от больного, но и для выявления антител к возбудителю в сыворотке крови (серодиагностика). В последнем случае убитую культуру возбудителя обрабатывают сывороткой больного с последующим добавлением в систему меченных флюорохромом антител к IgG человека. Наблюдаемое в последующем свечение микроорганизма говорит о возникновении сложного иммунного комплекса - микроб + антитела из сыворотки больного класса IgG + люминесцирующие анти-IgG МКАТ. Такую реакцию называют реакцией непрямой иммунофлюоресцепнции (РНИФ).
Другой способ иммуноанализа - радиоиммунный анализ. Он основан на использовании моноклональных антител, меченных радиоизотопом. Присоединение таких антител к специфичному им объекту, придает последнему радиоактивность, что может быть определено с помощью специальных приборов.
Наконец, еще один высоко перспективный способ мечения моноклональных антител - с помощью фермента. В качестве последнего чаще всего используют растительный фермент - пероксидазу хрена. Обработка изучаемого объекта такими антителами требует последующего нанесения «хромогена» - субстрата для фермента, меняющего цвет при образовании перекиси. В результате объект для специфического присоединения меченых антител приобретает окрашивание, которое может быть зарегистрировано спектрофотометром, а метод получил название ИФА.
ИФА, как и описанный выше иммунофлуоресцентный анализ, можно воспроизводить в виде прямого (выявление антигенов возбудителя в биологическом материале) и непрямого (выявление антител в сыворотке больного) методов. В конечном итоге с помощью ИФА можно обнаруживать микроорганизмы в материале от больного, противомикробные антитела и антитела к другим веществам антигенной природы. С введением в клиническую практику методов иммуноанализа и, в первую очередь, аппаратного ИФА, диагностические возможности врача-инфекциониста значительно возросли. Особенно это касается серодиагностики, поскольку появилась возможность устанавливать не только наличие антител к тому или иному возбудителю в сыворотке крови больного, но и определять принадлежность антител к тому или иному классу иммуноглобулинов, что повышает качество диагностики инфекционного заболевания. Дело в том, что антитела, принадлежащие разным классам иммуноглобулинов, выполняют различные функции (рис. 6.12).
Так, например, известно, что первый контакт человека с тем или иным возбудителем приводит к выработки IgM-антител, которая продолжается в течение примерно одного месяца. Эти антитела имеют большую молекулярную массу и не проникают через гистогемацитарные барьеры, поэтому обнаруживают их преимущественно в сыворотке крови. Обнаружение IgM-антител свидетельствует о развитии первичного иммунного ответа.
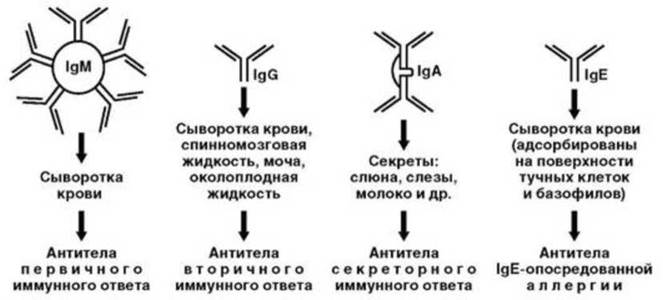
Рис. 6.12. Диагностически значимые классы антител и их функции
Уже со второй недели от начала контакта с патогеном в крови начинают накапливаться IgG-антитела. Вначале они сопутствуют IgM-антителам, а примерно через один месяц IgM-антитела начинают исчезать из кровотока и на смену им приходят IgG-антитела. При повторном поступлении антигена в организм вырабатываются уже только IgG-антитела, в связи с чем их называют антителами вторичного иммунного ответа.
Вначале способность к прочному взаимодействию с антигеном у IgG-антител не очень велика (IgG-антитела низкой авидности), но по мере развития инфекционного процесса (точнее, на третьем месяце от его начала) сила связывания этих антител с антигеном значительно возрастает вследствие селекции высоко специфичных клонов продуцирующих их В-лимфоцитов, т.е. появляются высоко авидныеIgG-антитела (рис. 6.13).
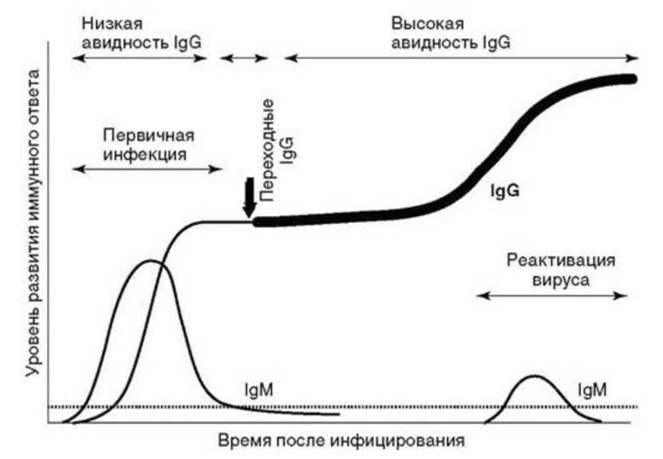
Рис. 6.13. Динамика выработки IgM- и IgG-антител
В соответствии с описанными закономерностями в тех случаях, когда очень важно установить давность инфицирования определяют не только содержание в крови IgM- и IgG-антител, но и авидность IgG-антител.
Такое исследование проводится, например, у беременных при выявлении у них инфицирования токсоплазмами. Токсоплазмоз беременных даже при его латентном течении создает угрозу инфицирования плода и развития врожденного токсоплазмоза, но только в том случае, если инфицирование женщины произошло в ходе беременности. Поэтому при обследовании беременной женщины на токсоплазмоз у нее обязательно устанавливаются не только уровни IgM- и IgG- антител, но и авидность IgG-антител. В этом случае наличие IgM-антител или низко авидных IgG-антител к токсоплазмам, особенно во II и III триместрах, свидетельствует в пользу заражения женщины уже в ходе беременности и требует проведения лечебных мероприятий.
Определение уровня IgA-антител имеет значение при исследовании секретов слизистых оболочек, в тех случаях, когда последние служат входными воротами инфекции. IgA-антитела начинают вырабатываться одновременно с IgG и около 80% из них поступают в секреты слизистых оболочек. После исчезновения инфекционного агента из организма IgA-антитела еще в течение 2-4 мес продолжают секретироваться, а затем исчезают. Если же микроб продолжает персистировать в организме, IgA-антитела продолжают регистрироваться в секретах. В связи с этой особенностью обнаружение IgA-антител в отсутствие клинических проявлений заболевания или через полгода после их исчезновения считают признаком хронического инфицирования.
Рост в сыворотке крови IgE-антител к тому или иному антигену, как правило, является свидетельством развития IgE-опосредованной аллергии к нему. В инфекционной практике подобное состояние особенно часто сопутствует инфекционно-аллергическим осложнениям (кардит, полиартрит), а также грибковым инфекциям и гельминтозам и сопровождается развитием клинических признаков аллергического процесса.
Таблица 6.9. Иммунологический метод в диагностике бактериальных инфекций
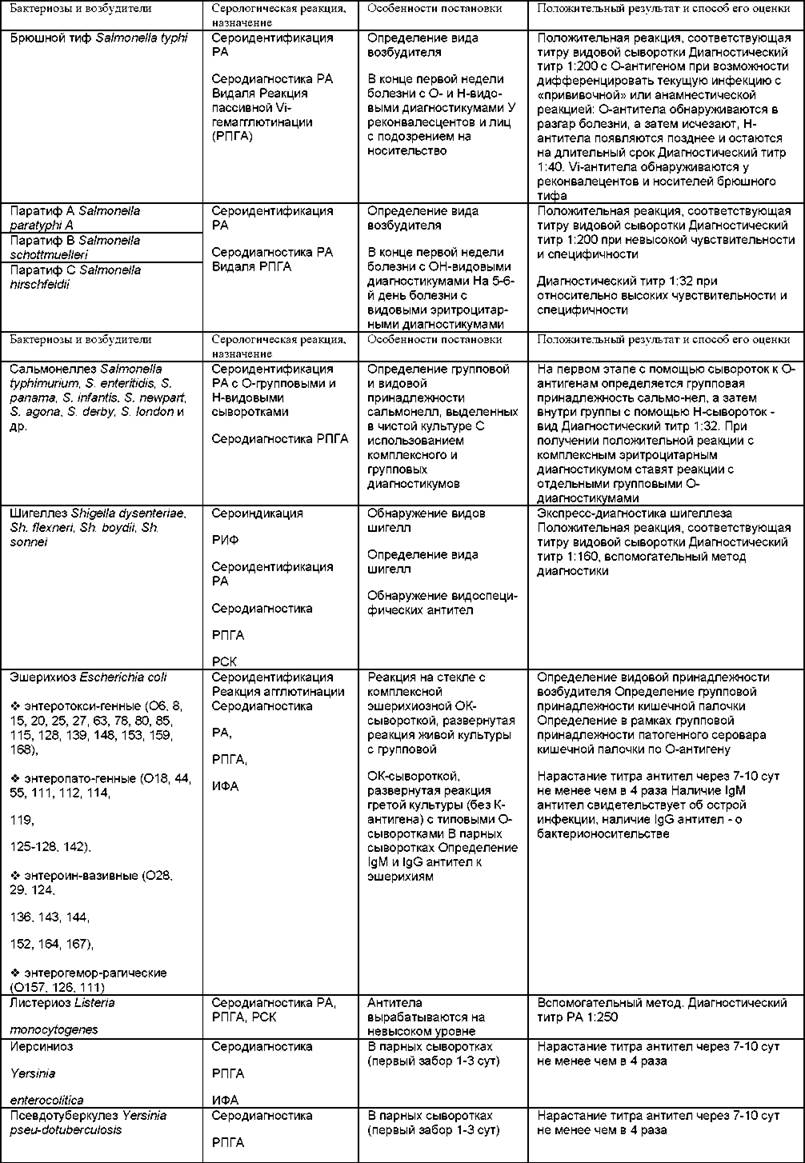
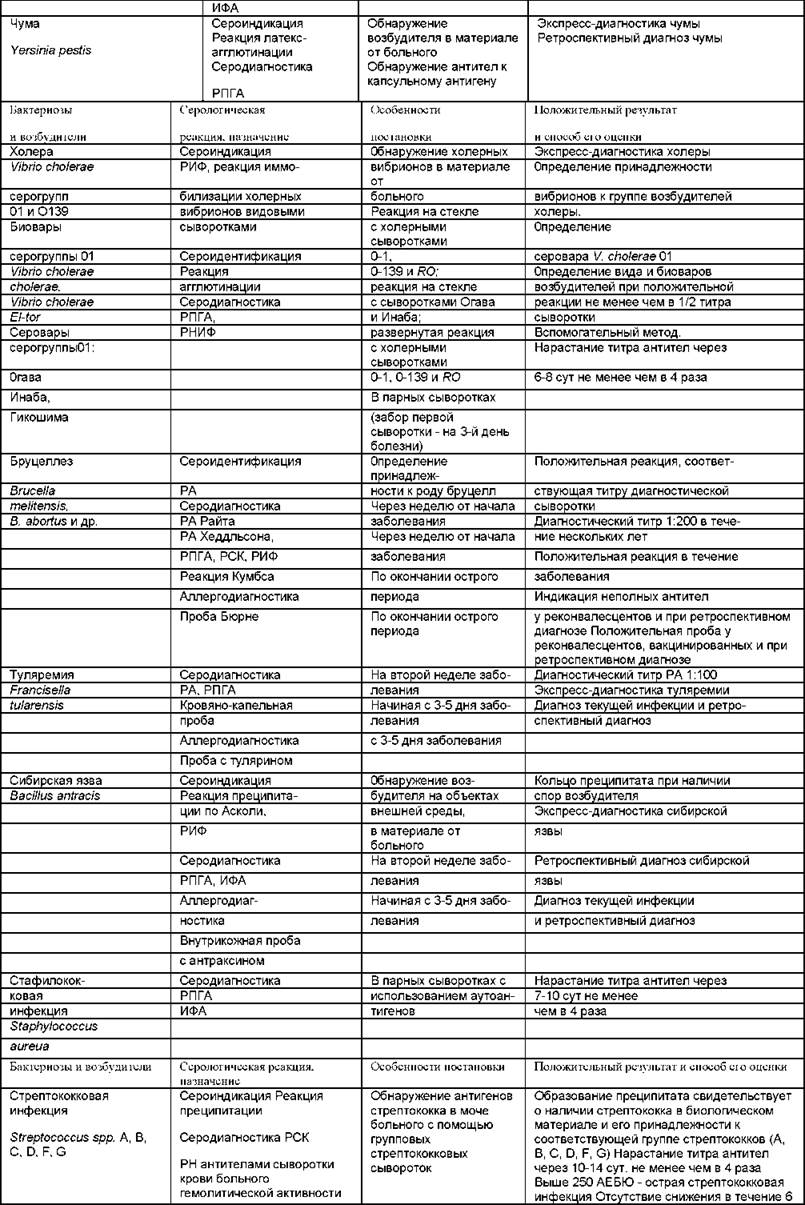
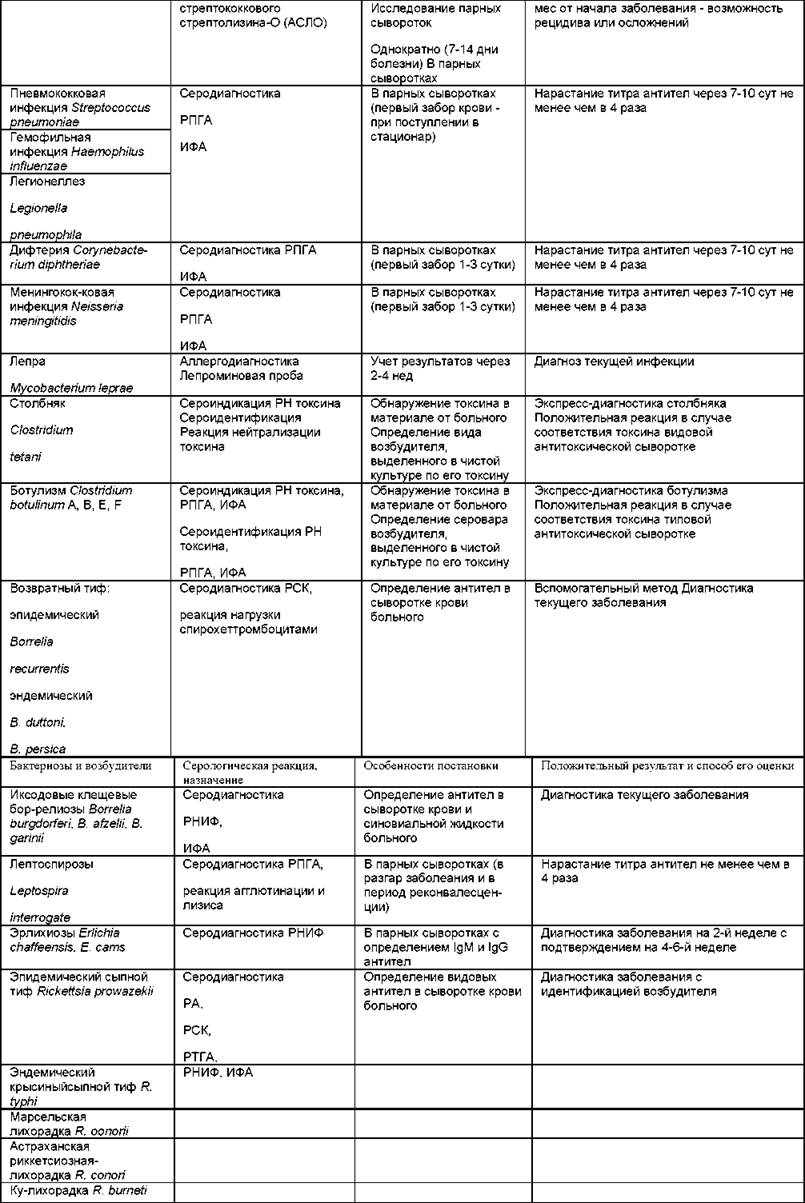
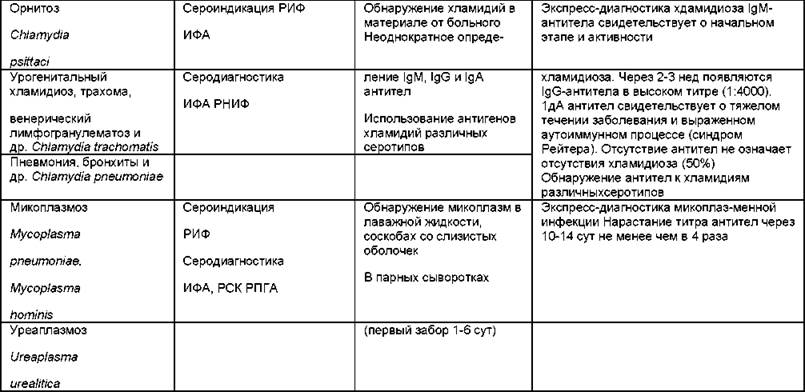
Таблица 6.10. Иммунологический метод в диагностике протозоонозных и паразитарных инфекций
|
Протозооз и возбудитель |
Серологическая реакция и ее назначение |
Особенности постановки |
Положительный результат и способ его оценки |
|
Амебиаз Entamoeba hystolitica |
Серодиагностика РПГА, ИФА |
В парных сыворотках |
Нарастание титра антител через 10-14 сут не менее чем в 4 раза при внекишечном амебиазе и наличии тканевых форм |
|
Токсоплазмоз Toxoplasma gondii |
Серодиагностика РНИФ ИФА |
В парных сыворотках с определением IgM и IgG антител, а также авидности IgG антител |
Нарастание титра антител через 10-14 сут не менее чем в 4 раза говорит о наличии токсоплазмоза, но не носительства. Определение IgM антител применяется для диагностики острого токсоплазмоза. Антитела IgG появляются в период реконвалесценции и сохраняются до 10 лет. Низкая авидность IgG антител говорит, что от момента заражения прошло не более 16 нед, высокая авидность - больший срок |
|
Криптоспоридиоз Cryptosporidium parvum |
Сероиндикация РИФ ИФА |
Обнаружение ооцист возбудителя в кале |
Экспресс-диагностика криптоспоридиоза |
|
Малярия Plasmodium vivax, P. malariae, P. ovale, P. falciparum |
Сероиндикация РИФ Серодиагностика РНИФ РПГА ИФА |
Обнаружение малярийных плазмодиев Через неделю от начала заболевания |
Экспресс-диагностика малярия Диагностический титр 1:80, в случае P. falciparum свидетельствует о свежей инвазии |
|
Лямблиоз Lamblia intestinalis (Giardia lamblia) |
Серодиагностика ИФА |
Обнаружение IgM антител |
Наличие IgM антител свидетельствует о лямблиозе, но не о носительстве |
|
Токсокароз Toxocara canis |
Серодиагностика РПГА, ИФА |
Обнаружение антител к возбудителю |
Основной метод диагностики при невозможности обнаружить возбудителя |
|
Шистосомоз Schistosoma haematobium, S. mansoni |
|||
|
Трихинеллез Trichinella spiralis |
Таблица 6.11. Иммунологические методы в диагностике вирусных инфекций
|
Вирусная инфекция |
Серологические маркеры |
Характерика маркеров |
Диагностическое значение |
|
ВГВ |
HBsAg |
Поверхностный антиген вируса гепатита В (HBV) |
Инфицированность HBV |
|
HBeAg |
Антиген инфекционно-сти HBV |
Репликация HBV в гепатоцитах, высокая инфекционность крови |
|
|
HBcAg |
Сердцевинный антиген HBV |
Репликация HBV в гепатоцитах, в крови в свободном виде не выявляется |
|
|
анти-НВс (total) (НВсАЬ) |
Суммарные антитела к HBcAg |
Ретроспективная диагностика ГВ, особенно, в отсутствие HBsAG и при неверифицированных гепатитах |
|
|
D анти-НВс (НВсАЬ IgM) |
Антитела класса М к сердцевинному антигену |
Ранний сывороточный маркер ГВ указывает на острую инфекцию, при ХГВ маркирует репликацию HBV и активность процесса в печени |
|
|
Вирусная инфекция |
Серологические маркеры |
Характерика маркеров |
Диагностическое значение |
|
Анти-НВе (HBeAb) |
Антитела к антигену инфекционности |
Начало стадии реконвалесценции (исключение - мутантная форма HBV) |
|
|
Анти-HBs (НВбАЬ) |
Протективные антитела к поверхностному антигену HBV |
Перенесенная инфекция или наличие поствакцинальных антител; обнаружение антител в первые недели ГВ прогнозирует развитие фульминантного гепатита |
|
|
Вирусный гепатит D (ВГй) |
IgM анти-HDV |
Антитела класса M к HDV |
Репликация вируса гепатита D (HDV) в организме |
|
IgG анти-HDV |
Антитела класса G к HDV |
Возможная инфицированность HDV или перенесенная инфекция |
|
|
HDAg |
Антиген HDV |
Mаркер наличия HDV в организме |
|
|
Вирусный гепатит С (ВГС) |
Анти-HCV IgG |
Антитела класса G к вирусу гепатита С (HCV) |
Возможная инфицированность HCV или перенесенная инфекция |
|
Анти-HCV core IgM |
Антитела класса M к сердцевинным белкам HCV |
Текущая инфекция (острая или хроническая в фазе реактивации) |
|
|
Анти-HCV core IgG |
Антитела класса G к сердцевинным белкам HCV |
Инфицированность HCV или перенесенная инфекция |
|
|
Анти-HCV NS |
Антитела к неструктурным белкам HCV |
Хроническая стадия гепатита С (ГС) |
|
|
ВГА |
IgM анти-HAV |
Антитела класса M к HAV |
Острая инфекция |
|
IgG анти-HAV |
Антитела класса G к HAV |
Перенесенная инфекция, сохраняются пожизненно |
|
|
ВГЕ |
IgM анти-HEV |
Антитела класса M к HEV |
Острая инфекция |
|
IgG анти-HEV |
Антитела класса G к HEV |
Перенесенная инфекция |
|
|
ВИЧ-инфекция |
р24 |
Сердцевинный белок ВИЧ |
2-8 нед после заражения, маркер развития СПИД |
|
IgM anti-p24 |
Антитела класса M к белку р24 ВИЧ |
Первые месяцы после заражения ВИЧ |
|
|
IgG anti-p24 |
Антитела класса G к белку р24 ВИЧ |
Текущая ВИЧ-инфекция |
|
|
IgG anti-gp41 IgG anti-gp120 IgG anti- gp160 |
Антитела класса G к поверхностным антигенам ВИЧ |
Текущая ВИЧ-инфекция через 3-6 мес после заражения |
|
|
Грипп |
Выявление антител в РСК, РТГА с использованием парных сывороток |
Ретроспективный диагноз, нарастание титра антител не менее чем в 4 раза |
|
|
Выявление антител в реакции радиального гемолиза |
Экспресс-диагностика гриппа |
||
|
Краснуха |
IgM-, IgG- |
0тсутствие антител (ИФА) |
Отсутствие заболевания в настоящее время и в анамнезе |
|
IgM-, IgG+ |
Наличие антител вторичного ответа |
Перенесенное заболевание в анамнезе |
|
|
IgM+, IgG- |
Наличие антител первичного ответа |
Заболевание в ранней стадии, период обострения |
|
|
IgM+, IgG+ |
Наличие антител первичного и вторичного ответа |
Период обострения |
|
|
Вирусная инфекция |
Серологические маркеры |
Характерика маркеров |
Диагностическое значение |
|
Корь |
Определение IgM и IgG антител методом ИФА |
Наличие IgM антител при отсутствии IgG характерно для острого периода (периода высыпаний) |
|
|
Определение антител в парных сыворотках методами РТГА, РСК |
Ретроспективный диагноз, нарастание титра антител не менее чем в 4 раза |
||
|
Эпидемический паротит |
Определение IgM и IgG антител методом ИФА |
Наличие IgM антител при отсутствии IgG характерно для острого периода |
|
|
Полиомиелит |
Выявление антител в сыворотке крови в реакции преципитации, РСК |
Выявление антител со 2-3-й недели заболевания |
|
|
Энтеровирусная инфекция |
ЭВ-специфические IgM |
Наличие антител первичного ответа |
Выявляются в сроки от первой недели заболевания до 6 мес от начала инфекции |
|
Вирусные диареи (рото-вирусная и норовирусная инфекция |
Определение антигенов вирусов в кале с помощью ИФА |
Экспресс-диагностика вирусных диарей (основной метод) |
|
|
Определение видовых антител к вирусам в сыворотке крови с помощью ИФА, РСК |
Вспомогательный метод |
||
|
ОРВИ |
Выявление видовых антител в РСК, ИФА с использованием парных сывороток |
Нарастание титра антител не менее чем в 4 раза |
|
|
Герпетическая инфекция |
Выявление антител к вирусу герпеса простого типа 1 и 2 в парных сыворотках крови методом ИФА |
Обострение инфекции при нарастании титра антител не менее чем в 4 раза |
|
|
Ветряная оспа |
Определение уровня IgM антител к Herpes zoster методом ИФА |
Острый период инфекции при наличии IgM |
|
|
Цитомегало-вирусная инфекция (ЦМВИ) |
Определение уровня IgM антител к цитомегаловирусу (ЦМВ) |
Нарастание титра IgM антител при обострении инфекции не ранее 4-й недели заболевания |
|
|
методом ИФАс использованием парных сывороток |
|||
|
Инфекционный мононуклеоз (вирус Эпштейна-Барр) |
Реакция Гоффа-Бауерра - неспецифическая серологическая реакция гетерогемагглютинации эритроцитов лошади со 2-й недели заболевания |
Ориентировочная диагностика инфекционного мононуклеоза при диагностическом титре 1:32 |
|
|
Определение уровня IgM и IgG антител к вирусу Эпштейна-Барр методом ИФА |
Острый пекриод инфекции при наличии IgM |
||
|
Натуральная оспа |
Выявление антител в РТГА, РСК, РН на куриных эмбрионах и в культурах клеток |
Ретроспективный диагноз |
|
|
Геморрагическая лихорадка |
Выявление видовых антител в РСК, РН, РИА (радиоиммунный анализ) с парными сыворотками |
Нарастание титра антител не менее чем в 4 раза |
|
|
Клещевой энцефалит |
Определение специфических антител классов IgM и IgG в сыворотке крови методами ИФА или РНИФ, а также авидности IgG |
Наличие антител класса IgM и низкоавидных IgG является показателем острой инфекции. При отсутствии симптоматики со стороны ЦНС основанием для постановки диагноза является одновременное обнаружение IgM- и IgG-антител либо 4-кратное увеличение концентрации IgG-антител в образце, взятом через 2-3 нед |
|
К молекулярно-биологическим методам диагностики инфекционных заболеваний относятся генетический анализ, протеомный анализ, липидный анализ, комбинированные методы.
К методам генетического анализа относятся ПЦР, рестрикционный анализ, молекулярная гибридизация, риботипирование, опосредованная транскрипцией амплификация рибосомальной рибонуклеиновой кислоты (РНК), высокопроизводительное секвенирование.
Наиболее широко в инфекционной практике применяется ПЦР. Основной принцип этого метода представлен на рис. 6.14.
Суть ПЦР заключается в обнаружении в биологическом материале участков дезоксирибонуклеиновой кислоты (ДНК), специфичных для представителей того или иного вида микроорганизмов. ПЦР обладает очень высокой чувствительностью и позволяет обнаружить даже минимальные количества генетического материала, поскольку в содержание метода входит его селективная репликация до такого объема, когда он может быть зарегистрирован специальными приемами. Эта реакция не только чувствительна, но и высоко специфична. Первоначально использовался качественный вариант. В последующем был разработан количественный метод ПЦР (ПЦР в режиме реального времени), которая позволяет в условных единицах (число копий искомого гена в 1 мл исследуемого материала или МЕ) определять количество микроорганизма (микробную нагрузку). Этот количественный тест оказался очень полезным во врачебной практике при мониторинге больных хроническими вирусными инфекциями - хроническими вирусными гепатитами, ВИЧ-инфекцией и др. ПЦР в настоящее время является основным методом индикации возбудителей в организме инфекционного больного независимо от природы этих возбудителей - простейших, грибов, бактерий и бактериеподобных микроорганизмов, вирусов. Для исследования используются в зависимости от преимущественной локализации возбудителя кровь, СМЖ, моча, кал, экссудаты и т.д. Количественный вариант ПЦР позволяет в течение 1-2 сут оценить эффективность этиотропной терапии. При позитивном эффекте микробная нагрузка снижается в 100 раз и более, при негативном - остается на прежнем уровне или возрастает. Уровень микробной нагрузки помогает в ряде случаев оценить тяжесть течения болезни.
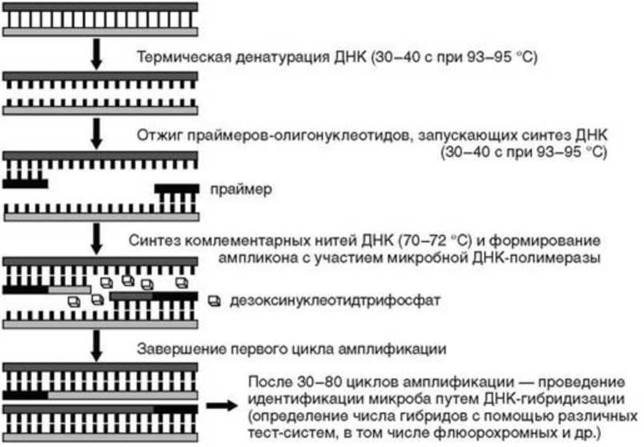
Рис. 6.14. Принцип и этапы полимеразной цепной реакции
Как правило используются наборы праймеров, соответствующие характеру инфекционного процесса. Например, для диагностики, вируса используют праймеры грамм+кокков и грамм-палочек.
Определять наличие какого-либо микроорганизма в биологическом материале можно путем рестрикционного анализа. Данный метод основан на применении ферментов, носящих название рестриктаз и позволяющих распознавать микроорганизмы определенного вида.
Принцип метода заключается в том, что в геноме микробов одного вида находится строго определенное (генетически детерминированное) число участков узнавания для определенной рестриктазы. В настоящее время из различных бактерий выделено и очищено более 175 различных рестриктаз, для которых известны сайты узнавания. Если выделенную из конкретного микроба ДНК обработать определенной рестриктазой, то это приведет к образованию строго определенного количества фрагментов ДНК фиксированного размера.
Размер каждого типа фрагментов можно узнать с помощью электрофореза в агарозном геле: мелкие фрагменты перемещаются в геле быстрее, чем более крупные фрагменты, и длина их пробега больше. Гель окрашивают бромистым этидием и фотографируют в ультрафиолетовом излучении. Сопоставляя полученную карту рестрикции ДНК с образцами видовых рестрикционных карт, можно выявить принадлежность анализируемого возбудителя к определенному виду или роду - даже такому, который находится за рамками предположений клинициста.
Еще один способ генетического анализа - молекулярная гибридизация, методически основанная на способности двухцепочечной ДНК при повышенной температуре (90 °С) в щелочной среде денатурировать, т.е. расплетаться на две нити, а при понижении температуры на 10 °С вновь восстанавливать исходную двухцепочечную структуру. Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить фиксируют на специальном фильтре, который затем помещают в раствор, содержащий радиоактивный зонд.
Зондом называется одноцепочечная молекула нуклеиновой кислоты определенного вида микроорганизма, меченная радиоактивными нуклидами, с которой сравнивают исследуемую ДНК. Когда создаются условия для восстановления двух-цепочечной структуры ДНК, зонд в случае наличия комплементарности между ним и исследуемой ДНК способствует образованию двойной спирали. Это позволяет выявить степень соответствия ДНК определяемого микроорганизма структуре зонда, что позволяет точно идентифицировать возбудителя инфекционного заболевания.
Принцип риботипирования основан на том, что последовательность нуклеотидных оснований в оперонах, кодирующих рибосомальную РНК (рРНК), отличается консервативностью, присущей каждому виду бактерий. Эти опероны представлены в бактериальной хромосоме в нескольких копиях. Количество и локализация копий оперонов рРНК варьируют в ДНК различных видов бактерий. Это свойство позволяет производить исследование выделенных штаммов на число копий оперонов и определять их вид. В настоящее время риботипирование проводится в автоматическом режиме в специальных приборах.
Опосредованная транскрипцией амплификация рРНК используется для диагностики смешанных инфекций. На первом этапе проводится амплификация (накопление) рРНК на матрице, выделенной из исследуемого материала ДНК при помощи ДНК- зависимой РНК-полимеразы. Далее проводится гибридизация накопленного пула рРНК с видоспецифическим олигонуклеотидами, меченными флюорохромом или ферментами. Исследование проводится в нескольких пробах соответственно тем видам микробов, наличие которых предполагается в составе биологического материала от больного. На заключительном этапе определяются продукты гибридизации методами иммуноф-люоресценции или ИФА. Реакция осуществляется в автоматическом режиме в установках, которые позволяют проводить одномоментное определение рРНК различных видов бактерий.
Высокопроизводительное секвенирование ампликонов используется для исследования видового состава прокариот в материале от больного путем исследования высококонсервативных участков генома, в частности гена 16S рРНК. В составе этого гена есть консервативные и вариабельные участки. В процессе исследования с помощью консервативных участов распознают ДНК бактерий, а вариабельные участки накапливают и идентифицируют в них последовательности, характерные для определенного вида бактерий. Метод позволяет устанавливать всю совокупность бактерий, присутствующих в исследуемом материале.
Все описанные способы генетического анализа обладают очень важным преимуществом перед остальными методами - они позволяют выявлять даже те виды микроорганизмов, которые невозможно культивировать ни одним из описанных выше способов.
Методы молекулярного, в том числе протеомного, анализа начали активно развиваться еще в начале 90-х гг. прошлого столетия.
Исследование совокупного белкового состава (протеома) биологических жидкостей осуществляют, в частности, используя соотношение массы отдельных белков к их заряду. В настоящее время все чаще для этих целей применяют времяпролетную матрично-активированную лазерную десорбцию/ионизацию - МАЛДИ-масс- спектрометрию. При туберкулезе, менингитах различной этиологии, микозах, ЦМВИ, инвазивной стрептококковой инфекции протеомные исследования рекомендуются для идентификации организмов по совокупности присущих им белков.
Принцип масс-спектрометрии и его использование в инфекционной практике значительно отличаются от любых других диагностических приемов (рис. 6.15).
Дело в том, что диагноз в данном случае ставится не только по обнаружению каких-то определенных белков микроорганизма или в организме больного человека, а по совокупности и соотношению белковых профилей биологического материала в целом. В результате прибором выдается протеомный профиль, например, СМЖ. Зная таковой у здорового человека (рис. 6.15, А), можно путем его сравнения с помощью специальных компьютерных программ с протеомным профилем больного (рис. 6.15, В) поставить диагноз менингита. Помимо общей протеинограммы методом масс- спектрометрии можно определять и конкретные белки в составе протеинограммы.
Липидный анализ имеет более ограниченное применение в инфекционной практике. Так, например, при диагностике инфекционных заболеваний, вызванных анаэробными бактериями, значительную помощь в определении видовой принадлежности возбудителей может оказать метод газо-жидкостной хроматографии (рис. 6.16).
Суть этого метода, используемого с указанной целью, заключается в том, что каждому виду анаэробных бактерий присущ свой уникальный набор образуемых ими жирных кислот. При этом каждая жирная кислота обладает специфичной для нее точкой перехода из жидкой в газообразную фазу. Прибор для газо-жидкостной хроматографии как раз и фиксирует эту точку перехода, благодаря чему становится возможным определить состав жирных кислот, присутствующих в материале от больного, и, соответственно, определить вид анаэробного возбудителя.
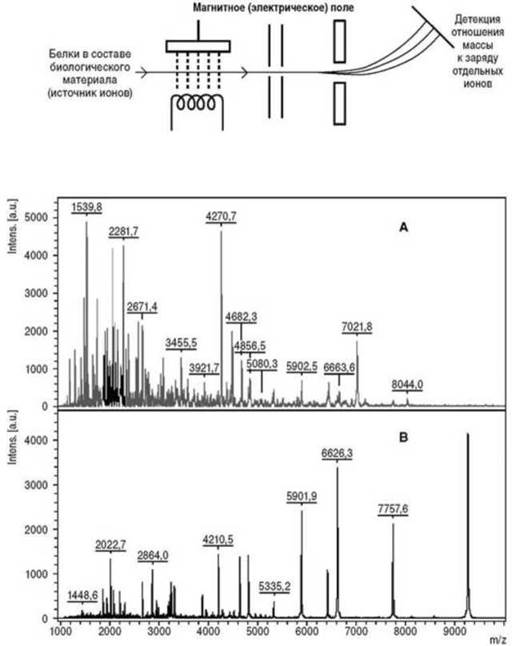
Рис. 6.15. Принцип масс-спектрометрии и протеограмма спинномозговой жидкости
К комбинированным методам молекулярной биологии относится, в частности, иммуноблоттинг. Этот метод сочетает в себе принципы молекулярной биологии и способа иммунодиагностики, как это показано на рис. 6.17.
Метод иммуноблоттинга востребован в тех случаях, когда врачу требуется информация не просто о наличии того или иного микроорганизма в материале от больного, а о наличии и количестве каждого антигена организма или антител к нему в биологическом материале. Такие сведения бывают необходимы при мониторинге больных некоторыми хроническими инфекционными заболеваниями, например ВИЧ-инфекцией. В этом случае врач, получая информацию о динамике того или иного антигена ВИЧ, может прогнозировать наступление следующей стадии инфекционного процесса.
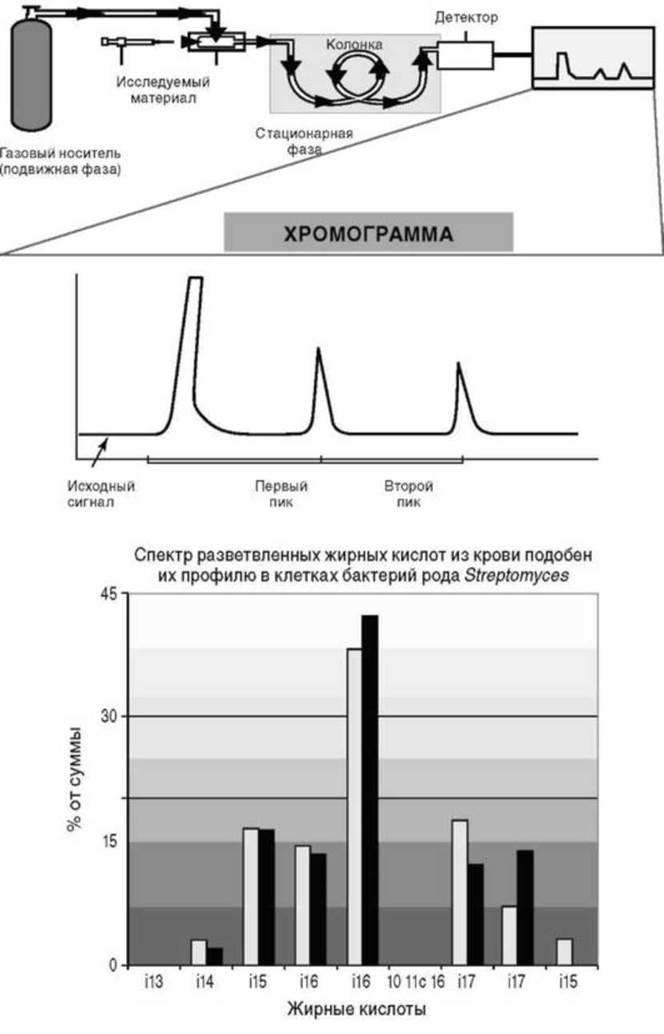
Рис. 6.16. Принцип метода газо-жидкостной хроматографии и пример диагностического использования этого метода
Что касается самой методики осуществления иммуноблоттинга, то она основана на том принципе, что каждый белковый субстрат обладает уникальной для него электрофоретической подвижностью. В связи с этим на первом этапе исследования биологический материал от больного подвергают электрофорезу в геле, в результате каждый вирусный белок «продвигается» в геле на разное расстояние. Затем с геля делается «нитроцеллюлозный слепок», который обрабатывается иммуноферметным методом с помощью меченных ферментом моноклональных антител к каждому вирусному белку. В результате получают нитроцеллюлозную полоску, на которой, как показано на рисунке, образуются цветовые фрагменты, при этом каждому вирусному белку соответствует свое расстояние от начала полоски.

Рис. 6.17. Этапы выполнения и результат иммуноблоттинга
Ориентируясь на наличие и ширину каждого цветного фрагмента, получают представление не только о наличии в организме, например, ВИЧ, но и том, сколько каждого вирусного белка или антител к нему циркулирует в организме. Так, например, высокое содержание белка каписида ВИЧ (р24) свидетельствует об активном прогрессировании вирусного процесса в стадию первичных проявлений, а динамика антител к р24 и другому поверхностному белку ВИЧ gp120 позволяет прогнозировать развитие СПИД или переход в терминальную стадию инфекционного процесса.
ЛИТЕРАТУРА
1. Лабораторная диагностика опасных инфекционных заболеваний / Под ред. Г.Г. Онищенко, В.В. Кутырева // М.: Медицина, Шико, 2009. - 472 с.
2. Лобзин Ю.В. Практика лабораторных исследований при инфекционных заболеваниях / Ю.В. Лобзин, Ю.П. Финогеев, В.Ф. Крумгольц // СПб.: Элби-СПб., 2005. - 274 с.
3. Медицинская лабораторная диагностика (программы и алгоритмы) / Под ред. А.И. Карпищенко // СПб.: Интермедика, 2001. - 304 с.
4. Медицинская микробиология, вирусология и иммунология: том 2: учебник / Под ред. В.В. Зверева, М.Н. Бойченко // 2010. - 474 с.
5. Ребриков Д.В. ПЦР в реальном времени / Д.В. Ребриков, Г.А. Саматов, Д.Ю. Трофимов и др. // М.: Бином. Лаборатория знаний, 2014. - 223 с.
6. Baron E.J. A Guide to Utilization of the Microbiology Laboratory for Diagnosis of Infectious Diseases: 2013 Recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM) / E.J. Baron, J.M. Miller, M.P. Weinstein et al. // Clinical Infectious Diseases Advance, 2013. http://cid.oxfordjournals.org